Efecto Debye. Efecto London. Dipolos instantáneos
De Wikillerato
Tabla de contenidos |
Fuerzas intermoleculares: Fuerzas de Van der Waals
Las fuerzas intermoleculares son aquellas fuerzas que se dan entre moléculas que mantienen las moléculas juntas a una cierta temperatura (estrictamente hablando el termino intermolecular se refiere solo a sustancias moleculares, aunque se usa también para hablar de fuerzas entre moléculas, iones y átomos). Las fuerzas intermoleculares como un conjunto se denominan normalmente fuerzas de Van der Waals en honor del científico holandés Johannes van der Waals (1837-1923). Estas fuerzas son de varios tipos, incluyendo las fuerzas dipolo-dipolo, dipolo permanente-dipolo inducido, las fuerzas de dispersión London y los [[ enlaces de hidrógeno ]. Además, una fuerza ion-dipolo opera entre iones y moléculas. Las fuerzas de Van der Waals tienen su origen en el movimiento de los electrones dentro de los átomo y moléculas. Así, todas estas fuerzas intermoleculares son de origen eléctrico y resultan de la atracción mutua de cargas de diferente signo o de la repulsión mutua de cargas del mismo signo. Si las partículas son iones, la cargas son completas y las interacciones ión-ión son fuertes (energías del orden de 500-1000 kJ/mol), dando origen a los enlaces iónicos. Si las moléclas son neutras elctricamene, entonces solo cargas parciales están presentes en el mejor de los casos, auque aún así, las fuerzas atractivas pueden ser sustanciales.
Fuerzas dipolo-dipolo
Las moléculas polares pero neutras eléctricamente experimentan fuerzas dipolo-dipolo como resultado de la interacción entre dipolos de moléculas cercanas. Las fuerzas pueden ser atractivas o repulsivas, dependiendo de la orientación de las moléculas, y la fuerza neta en una larga colección de moléculas resulta de la interacción de muchas interacciones individuales de ambos tipos. Las fuerzas son generalmente débiles con energía del orden de 3-4 kJ/mol, y son significativas cuando las moléculas están en un contacto cercano.
La fuerza de una interacción dipolo-dipolo depende del tamaño de los momentos dipolores involucrados. Cuanto más polar es la sustancia, más grande es la interacción dipolo-dipolo. Por ejemplo el butano, es una molécula no polar con una masa molecular de 58 u.m.a, y un punto de ebullición de -0.5 ºC, mientras que la acetona con la misma masa molecular bulle a 57 ºC debido a que es polar.
Fuerzas dipolo permanente-dipolo inducido
Una molécula polar con un momento dipolar 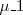 puede inducir en una molécula polarizable (la cual puede ser tanto polar como apolar) un dipolo inducido
puede inducir en una molécula polarizable (la cual puede ser tanto polar como apolar) un dipolo inducido 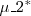 . El dipolo inducido interacciona con el dipolo permanente de la primera molécula, y las dos son atraídas entre si. Esta fuerza se denomina a veces fuerza de Debye, en honor del fisico-químico holandés Peter J.W. Debye (1884-1966).
. El dipolo inducido interacciona con el dipolo permanente de la primera molécula, y las dos son atraídas entre si. Esta fuerza se denomina a veces fuerza de Debye, en honor del fisico-químico holandés Peter J.W. Debye (1884-1966).
Las energía de interacción dipolo/inducido-dipolo es independiente de la temperatura pero al igual que la interacción dipolo-dipolo es dependiente de 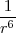 .
.
Fuerzas de dispersión o fuerzas de London
Las [[moléculas apolares] pueden interaccionar aunque no tengan un momento dipolar permanente. La interacción entre moléculas no polares se origina por la parición de dipolos instantáneos transitorios que todas las moléculas poseen como resultado de los cambios en las posiciones instantáneas de los electrones. Supongamos que los electrones en una molécula cambian hacia una ordenación electrónica que origina un momento dipolar instantáneo. Este dipolo polariza a otra molécula e induce en ella un momento dipolar también instantáneo. Los dos dipolos se atraen mutuamente y la energía potencial del par disminuye en consecuencia. Aunque la primera molécula cambiara de tamaño y la dirección de su dipolo la segunda molécla seguirá a la primera, esto es los dos dipolos están “correlacionados” en su dirección. Debido a esta correlación, la atracción entre los dos dipolos instantáneos en promedio no es cero y da origen a una interacción dipolo inducido-dipolo inducido. Este efecto es denominado efecto London, nombre dado en honor a su descubridor del físico germano-americano Fritz W. London (1900-1954). Todos los átomos y moléculas experimentan fuerzas de dispersión de London, la cual en definitiva resultan del movimiento de los electrones.
Imagen:Dipolo inducido-Dipolo inducido.jpg
Por ejemplo el benceno (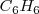 ) es una molécula que tiene momento dipolar cero y por lo tanto no experimenta fuerzas dipolo-dipolo. No obstante debe haber alguna fuerza intermolecular entre las moléculas de benceno debido a que la sustancia es un líquido más bien que un gas a temperatura ambiente, con un punto de fusión de 5.5 ºC y un punto de ebullición de 80.1 ºC. Por otra parte, si tenemos una molécula apolar como el
) es una molécula que tiene momento dipolar cero y por lo tanto no experimenta fuerzas dipolo-dipolo. No obstante debe haber alguna fuerza intermolecular entre las moléculas de benceno debido a que la sustancia es un líquido más bien que un gas a temperatura ambiente, con un punto de fusión de 5.5 ºC y un punto de ebullición de 80.1 ºC. Por otra parte, si tenemos una molécula apolar como el 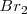 promediado sobre el tiempo, la distribución de los electrones a través de la molécula es simétrica (esto es la apolaridad molecular es un concepto estadístico, porque los electrones y los núcleos no se pueden considerar objetos puntuales fijos en el espacio, sino que fluctúan constantemente y hay momentos en los que los centros positivo y negativo de la carga eléctrica no coinciden). En esos momentos aparece de hecho un dipolo instantáneo. Y estos dipolos instantáneos que aparecen aleatoriamente en al población molecular interaccionan con las moléculas vecinas y generan en ellas dipolos inducidos. Las interacciones dipolo instantáneo-dipolo inducido aunque efímeras y aleatorias, producen una cohesión global entre la población molecular que se significa como fuerzas de dispersión o fuerzas de London, pero en cualquier instante puede haber muchos más electrones en un polo de la molécula que en el otro dándole a la molécula un dipolo instantáneo de corta vida. Este dipolo instantáneo en una molécula puede afectar la distribución de carga en las moléculas vecinas e inducir temporalmente dipolos en esas moléculas, Como resultado una débil atractiva fuerza se desarrolla y la molécula de
promediado sobre el tiempo, la distribución de los electrones a través de la molécula es simétrica (esto es la apolaridad molecular es un concepto estadístico, porque los electrones y los núcleos no se pueden considerar objetos puntuales fijos en el espacio, sino que fluctúan constantemente y hay momentos en los que los centros positivo y negativo de la carga eléctrica no coinciden). En esos momentos aparece de hecho un dipolo instantáneo. Y estos dipolos instantáneos que aparecen aleatoriamente en al población molecular interaccionan con las moléculas vecinas y generan en ellas dipolos inducidos. Las interacciones dipolo instantáneo-dipolo inducido aunque efímeras y aleatorias, producen una cohesión global entre la población molecular que se significa como fuerzas de dispersión o fuerzas de London, pero en cualquier instante puede haber muchos más electrones en un polo de la molécula que en el otro dándole a la molécula un dipolo instantáneo de corta vida. Este dipolo instantáneo en una molécula puede afectar la distribución de carga en las moléculas vecinas e inducir temporalmente dipolos en esas moléculas, Como resultado una débil atractiva fuerza se desarrolla y la molécula de 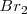 es un líquido a temperatura ambiente en vez de un gas.
es un líquido a temperatura ambiente en vez de un gas.
Las fuerzas de dispersión London son generalmente pequeñas, con energía que varían entre 1-10 kJ/mol, y su exacta magnitud depende de la facilidad con la que la nube electrónica de la molécula se puede distorsionar por un campo eléctrico débil, una propiedad referida como polarizabilidad. Una molécula pequeña o un átomo ligero es menos polarizable y tiene una menor fuerza de dispersión debido a que tiene unos pocos electrones muy unidos. Una molécula o átomo más grande, es más polarizable y tiene una más grande fuerza de dispersión debido a que tiene muchos más electrones, algunos de los cuales están menos fuertemente ligados al estar más lejos del núcleo. Entre los halógenos por ejemplo la molécula de 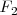 es pequeña y menos polarizable, mientras que la molécula de
es pequeña y menos polarizable, mientras que la molécula de 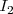 es más grande y más polarizable. Como resultado <mathF_2 </math> tiene fuerzas de dispersión menores y es un gas a temperatura ambiente, mientras que el
es más grande y más polarizable. Como resultado <mathF_2 </math> tiene fuerzas de dispersión menores y es un gas a temperatura ambiente, mientras que el 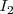 tiene fuerzas de dispersión London más grandes y es un sólido a esa temperatura.
tiene fuerzas de dispersión London más grandes y es un sólido a esa temperatura.
La forma de la molécula también es importante en determinar la magnitud de la fuerzas de dispersión London. Cuanto más alargada sea la molécula, lo que maximiza el área de superpie molecular, permite un contacto más grande entre moléculas y da origen a unas fuerzas de dispersión más grandes que aquellas moléculas con formas más compactas, las cuales minimizan el contacto molecular. Por ejemplo el pentano, a 309.4 K, mientras que el 2,2,dimetilpropano a 282.7 K, a pesar de que las dos sustancias tiene la misma forma 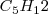 , pero el pentano es más largo y expandido, mientras que el 2,2-dimetilpropano es más esférico y compacto.
, pero el pentano es más largo y expandido, mientras que el 2,2-dimetilpropano es más esférico y compacto.
Las fuerzas entre moléculas apolares son, en general, muy débiles y no son direccionales. No obstante son las causantes de la licuefacción y solidificación de las moléculas no polares, como por ejemplo, la de los gases nobles. Las fuerzas de London aparecen siempre en toda clase de moléculas polares o apolares, aunque pueden quedar eclipsadas por otras fuerzas de mayor intensidad
Tweet