Energía de enlace. Longitud de los enlaces. Polaridad. Influencia de la longitud del enlace en la acidez
De Wikillerato
Tabla de contenidos |
Energía de disociación de enlace
La cantidad de energía que debe ser suministrada para romper un enlace químico en una molécula aislada y que debe ser liberada cuando el enlace se forma se denomina energía de disociación de enlace (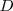 ). Las energías de disociación tienen siempre valores positivos debido a que la energía debe ser siempre suministrada para romper el enlace. Y al contrario, la cantidad de energía liberada en formar un enlace es siempre de valor negativo.
). Las energías de disociación tienen siempre valores positivos debido a que la energía debe ser siempre suministrada para romper el enlace. Y al contrario, la cantidad de energía liberada en formar un enlace es siempre de valor negativo.
Definida de manera cuantitativa se llama energía de enlace a la variación de entalpía, que en condiciones estándar (25 ºC y 1 atm) que se acompaña a la ruptura de un mol de enlaces de determinado tipo. La variación de entalpía se puede expresar indistintamente en kilojulios o kilocalorías, teniendo siempre en cuenta el factor de conversión 1 cal= 4,18 J).
Por ejemplo, la ruptura del enlace 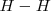 en la molécula de hidrógeno
en la molécula de hidrógeno 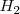 la podemos representar así:
la podemos representar así:
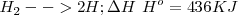
De otra manera, la energía de enlace es la que se desprende cuando se forma el mismo:
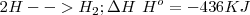
|
Cada enlace en cada molécula tiene su propia energía de disociación de enlace específica. Por elllo no es sorprendente que los enlaces entre los mismos pared de átomos tengan usualmente energía de disociación similar. Por ejemplo, los enlaces carbono-carbono (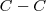 ) tienen un valor de
) tienen un valor de 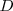 de aproximadamente 350-380 kJ/mol independiente de la estructura exacta de la molécula.
de aproximadamente 350-380 kJ/mol independiente de la estructura exacta de la molécula.
Debido a que enlaces similares tienen energía de disociación similares, es posible construir una tabla de valores promedios que permite comparar diferentes clases de enlaces. Hay que tener en cuanta no obstante que el valor real en una molécula específica puede variar en un 10 % en promedio, porque el valor concreto de la energía depende del entorno químico de los átomos enlazados.
Las energía de disociación de enlace cubren un amplio rango de valores, desde los 151 kJ/mol del enlace 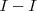 a valores tan altos como
a valores tan altos como 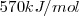 para el enlace
para el enlace 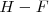 . La mayoría de los enlaces encontrados en moléculas naturales (enlaces
. La mayoría de los enlaces encontrados en moléculas naturales (enlaces  ) tienen valores en el rango de 350-400 kJ/mol.
) tienen valores en el rango de 350-400 kJ/mol.
Por otra parte, hay que decir que el valor de la energía de un enlace múltiple no es múltiplo de la energía de un enlace sencillo, sino que es una magnitud propia e independiente.
Longitud de enlace
Polaridad
Los enlaces iónicos y covalentes representan solo los dos extremos en un continuo espectro de posibilidades. Es decir, los enlaces covalentes puros y los enlaces iónicos puros no representan los tipos mayoritarios de enlaces. Entre los dos extremos están la mayoría de los enlaces, en los cuales los electrones del enlace son compartidos de manera desigual entre los dos átomos sin ser completamente transferidos. Tales enlaces se denominan enlaces covalentes polares, y la propiedad de poseerlos polaridad. La letra minúscula delta es utilizada para simbolizarlas cargas parciales resultantes en los átomos, o parcialmente positiva (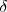 ) para el átomo que tiene los electrones de enlace menos compartidos y parcial negativa, para los átomos que tienen una mayor compartición.
) para el átomo que tiene los electrones de enlace menos compartidos y parcial negativa, para los átomos que tienen una mayor compartición.
Por ejemplo, en una molécula de cloro 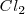 es una molécula homonuclear, compuesta por dos átomos del mismo elemento. Por ello, dado que la pareja electrónica del enlace covalente compartida por los dos átomos de cloro está sometida a la misma fuerza por los dos átomos, se situará en una posición equidistante de ambos. Los centros positivos y negativos de la molécula coinciden, y a consecuencia de Ellora molécula será apolar. El enlace se denomina entonces covalente apolar o covalente puro.
es una molécula homonuclear, compuesta por dos átomos del mismo elemento. Por ello, dado que la pareja electrónica del enlace covalente compartida por los dos átomos de cloro está sometida a la misma fuerza por los dos átomos, se situará en una posición equidistante de ambos. Los centros positivos y negativos de la molécula coinciden, y a consecuencia de Ellora molécula será apolar. El enlace se denomina entonces covalente apolar o covalente puro.
Por otra parte, en la molécula heteronuclear del cloruro de hidrógeno 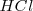 ocurre que el átomo de cloro es más electronegativo que el hidrógeno, por lo que la pareja enlazante de electrones del enlace estará algo desplazada hacia el cloro. Esto supone la aparición de cierta carga negativa sobre el cloro (
ocurre que el átomo de cloro es más electronegativo que el hidrógeno, por lo que la pareja enlazante de electrones del enlace estará algo desplazada hacia el cloro. Esto supone la aparición de cierta carga negativa sobre el cloro (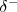 ) , mientras que por el contrario aparecerá en el hidrógeno una carga igual pero de signo opuesto (i.e. parcial positiva (
) , mientras que por el contrario aparecerá en el hidrógeno una carga igual pero de signo opuesto (i.e. parcial positiva (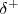 ). Estas cargas no llegan a la magnitud de la que portan un electrón o un protón, porque en este caso habaríamos de iones, es decir de enlace iónico. El enlace del
). Estas cargas no llegan a la magnitud de la que portan un electrón o un protón, porque en este caso habaríamos de iones, es decir de enlace iónico. El enlace del 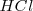 es pues covalente, pero al mismo tiempo parcialmente iónico, de denomina por ello enlace covalente polar.
es pues covalente, pero al mismo tiempo parcialmente iónico, de denomina por ello enlace covalente polar.
Si el átomo enlazado al cloro es un elemento muy electronegativo, como puede ser el sodio, el desplazamiento de la carga sería mucho más intenso que en el caso del cloruro de hidrógeno. Así el cloro, en el cloruro de sodio 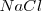 habría aquirido una carga negativa -1 , mientras que el sodio estaría cargado con una positiva +1, y el enlace sería iónico.
habría aquirido una carga negativa -1 , mientras que el sodio estaría cargado con una positiva +1, y el enlace sería iónico.



