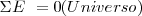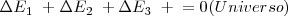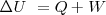Energía interna: Primer principio de la Termodinámica
De Wikillerato
| (Una edición intermedia no se muestra.) | |||
Revisión actual
El primer principio de la termodinámica también conocido como la Ley de la conservación de la energía dice que la energía total del Universo es constante. En otras palabras, la energía ni se puede crear ni se puede destruir solo se puede transformar en diferentes formas.
En general este principio se puede expresar matemáticamente en la siguiente ecuación:
Diferentes procesos que involucran cambios de energía 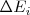 pueden ocurrir en el Universo, pero su suma debe ser cero. Esto es:
pueden ocurrir en el Universo, pero su suma debe ser cero. Esto es:
En Termodinámica el primer principio puede ser enunciado para un sistema cerrado (cuya energía potencial y cinética no cambia) y para cualquier proceso que acaba y termina con estados de equilibrio:
La variación de energía interna 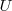 en un sistema es igual al calor neto
en un sistema es igual al calor neto 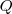 añadido más el trabajo
añadido más el trabajo 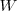 realizado por el sistema.
realizado por el sistema.
La ecuación que expresa que la variación de energía interna 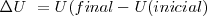 está relacionada con la energía intercambiada con sus alrededores bien en forma de calor (
está relacionada con la energía intercambiada con sus alrededores bien en forma de calor (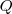 ) y/o de trabajo (
) y/o de trabajo (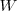 ) que el sistema realiza sobre el ambiente exterior (alrededores), o este sobre el sistema. La energía interna
) que el sistema realiza sobre el ambiente exterior (alrededores), o este sobre el sistema. La energía interna  es una función de estado. El hecho de que
es una función de estado. El hecho de que 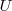 es una función de estado implica que el cambio
es una función de estado implica que el cambio 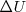 en la energía interna entre dos estados de un sistema es independiente del camino entre ellos. Por otra parte
en la energía interna entre dos estados de un sistema es independiente del camino entre ellos. Por otra parte 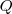 y
y 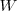 no son funciones de estado. Debido a que estos son modos de transferencia de energía por los que se puede cambiar el valor de la energía interna, no mantienen su entidad separada después de que la transferencia de energía haya terminado.
no son funciones de estado. Debido a que estos son modos de transferencia de energía por los que se puede cambiar el valor de la energía interna, no mantienen su entidad separada después de que la transferencia de energía haya terminado.
La definición de 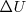 en términos de
en términos de 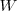 y de
y de 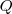 es un medio sencillo para medir el cambio de energía interna de un sistema cuando un cambio energético tiene lugar en él, por ello la independencia del cambio math>\DeltaU\</math> del camino por el cual se realiza es de gran importancia en Química. Así, la primera ley de la termodinámica proporciona un medio para calcular la cantidad de trabajo y de calor transferido en varios procesos, incluyendo procesos adiabáticos.
es un medio sencillo para medir el cambio de energía interna de un sistema cuando un cambio energético tiene lugar en él, por ello la independencia del cambio math>\DeltaU\</math> del camino por el cual se realiza es de gran importancia en Química. Así, la primera ley de la termodinámica proporciona un medio para calcular la cantidad de trabajo y de calor transferido en varios procesos, incluyendo procesos adiabáticos.
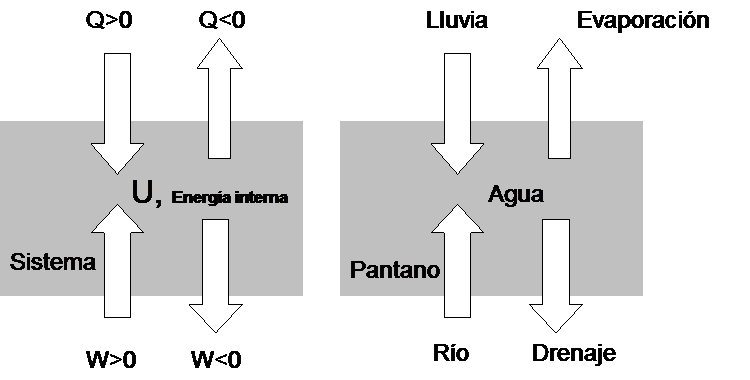
Para comprender 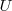 como una función de estado se puede utilizar la siguiente analogía:
como una función de estado se puede utilizar la siguiente analogía:
La transferencia de calor a un sistema es análoga a la caída de agua de lluvia en un pantano, el trabajo hecho sobre el sistema es análogo al flujo de un curso de agua (e.g., río) que termina en el pantano, y la energía interna es análoga al agua del pantano. Evaporación (similar a una lluvia pero con signo negativo) es análoga al flujo de calor a los alrededores del sistema y el drenaje del flujo del pantano a un segundo curso de agua (e.g., arroyo) es similar al trabajo hecho sobre los alrededores. Una vez que el agua a ha llegado al pantano no es identificable por el medio que ha llegado al pantano solo queda como agua. Así, una vez que un curso de agua ha desembocado en el pantano, el agua es identificable como agua no como agua de un curso de agua. La cantidad de agua en el pantano es una cantidad bien definida (una función de estado), pero uno no puede decir cuanta agua del pantano procedente de la lluvia o de un curso de agua. De igual manera no hay una cosa como contenido de calor de un sistema en un determinado estado ni una cosa como contenido de trabajo en un estado dado del sistema.
La experimental evidencia para la Primera Ley es la imposibilidad de construir una “máquina de movimiento perpetuo de primera especie”, un mecanismo para producir trabajo sin consumir combustible (energía), esto es una máquina que produzca más energía de la que la que toma, dicha máquina realizaría así trabajo cíclicamente sin tomar energía del medio. Nunca se ha encontrado una máquina que cree energía interna para remplazar la energía empleada para hacer trabajo. No se puede extraer energía interna de un sistema como trabajo, dejar el sistema aislado durante cierto tiempo con la esperanza que cuando volvamos a trabajar con aquel, el nivel de energía interna haya sido restaurado a su nivel original. Aparentes violaciones de la conservación de la energía condujo a los Físicos a la búsqueda de partículas desconocidas que pudieran dar cuenta de la energía transferida o extraída del sistema conduciendo al descubrimiento del neutrino.
Hay que enfatizar que en la formulación de la primera ley contiene tres ideas relacionadas: la existencia de una función de energía interna, el principio de conservación del la energía y la definición de calor y trabajo como modos de energía en transito, el caso del calor en virtud de las diferencia de temperaturas entre diferentes sistemas.
Referencias
J. Bevan Ott and Juliana Boerio-Goates. Chemical Thermodynamics: Principles and Applications. 2000. Elsevier Academic Press.
Peter Atkins. Physical Chemistry for the Life Sciences. 2005, Oxford University Press.
Robert G. Mortimer. Physical Chemistry. Third Edition. 2008. Elsevier Academic Press.
Tweet