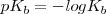Equilibrio de las disoluciones de ácidos y bases débiles. Relaciones entre la fuerza de los ácidos y su K de ionización en disolución acuosa
De Wikillerato
Equilibrio en las disoluciones de ácidos débiles y bases débiles
Como para cualquier otro equilibrio químico, la disociación (ionización) de un ácido débil y una base débil en agua es caracterizada por una ecuación de equilibrio. En este caso, la constante de equilibrio para la reacción de disociación denotada 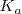 es llamada constante de acidez para los ácidos y
es llamada constante de acidez para los ácidos y 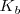 constante de basicidad para las bases.
constante de basicidad para las bases.
En general:
Para los ácidos débiles la ecuación de equilibrio es:
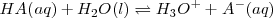
Y la constante de acidez está definida por la relación:
La concentración de ![[H_2O] [H_2O]](/images/math/math-811bb632ecfa129d0b373828d8367378.png) , es esencialmente constante en soluciones acuosas diluidas, ha sido incorporada en la constante de equilibrio
, es esencialmente constante en soluciones acuosas diluidas, ha sido incorporada en la constante de equilibrio 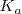 y por lo tanto es omitida en la constante de equilibrio.
Una base débil como el amoniaco
y por lo tanto es omitida en la constante de equilibrio.
Una base débil como el amoniaco 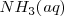 acepta un protón del agua para dar el ácido conjugado de la base y iones
acepta un protón del agua para dar el ácido conjugado de la base y iones 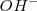 :
:
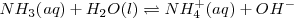
La reacción en el equilibrio de cualquier base (abreviadamente 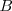 ) con el agua es caracterizada por una ecuación similar en forma a aquella para la disociación de un ácido débil. En este caso es llamada constante de basicidad
) con el agua es caracterizada por una ecuación similar en forma a aquella para la disociación de un ácido débil. En este caso es llamada constante de basicidad 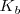
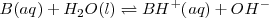
De nuevo la concentración del agua 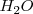 ha sido omitida de la ecuación y es incorporada a la constante
ha sido omitida de la ecuación y es incorporada a la constante 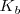 .
.
La constantes 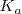 y
y 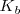 indican la mayor o menor extensión de la disociación de ácidos y bases débiles. Cuanta más pequeña sea la constante más débil será el ácido o la base correspondiente.
indican la mayor o menor extensión de la disociación de ácidos y bases débiles. Cuanta más pequeña sea la constante más débil será el ácido o la base correspondiente.
Relaciones entre la fuerza de los ácidos y su K de ionización en disolución acuosa: pKa y pKb
Una manera útil de caracterizar la extensión de disociación (ionización) de un ácido débil o una base débil es aplicar (al igual que se hizo para el pH) la forma logarítmica a las constantes de acidez y de basicidad, definiéndose así el 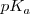 y el
y el 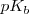 como:
como:
En este caso si utilizamos la expresión logarítmica pK, cuanta más alta sea esta más débil será el ácido o la base.
Tweet

![K_a= \frac{[H_3O^+ [A]^-}{[HA]} K_a= \frac{[H_3O^+ [A]^-}{[HA]}](/images/math/math-6b26a49f57c78062afdf3851efb5a02e.png)
![K_b=\frac{[BH]^+ [OH]^-}{[B]}} K_b=\frac{[BH]^+ [OH]^-}{[B]}}](/images/math/math-d806c88d2b128a8e0c90cd51f3e07d41.png)