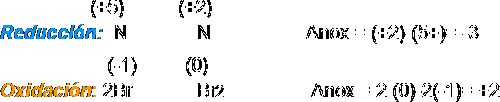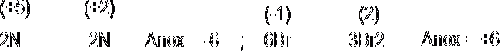Reacciones de oxidación-reducción. Ajuste estequiométrico
De Wikillerato
(Ajusto ancho de imágenes e incluyo plantilla de teorema) |
|||
| Línea 71: | Línea 71: | ||
===Método del ión-electrón=== | ===Método del ión-electrón=== | ||
| - | [Categoría: Química]] | + | [[Categoría: Química]] |
Revisión de 08:47 2 sep 2010
Tabla de contenidos |
Ajuste estequiométrico de reacciones redox
Introducción
Ajustar una reacción química significa poner los coeficientes numéricos que sean necesarios a las sustancias que intervienen en la misma para que se cumpla el principio de conservación de los átomos de cada elemento al efectuarse la reacción.
En las reacciones sencillas este ajuste puede hacerse por tanteo sin mayores dificultades. Pero a medida que las reacciones son más complicadas el método del tanteo se vuelve complicado. Por ello es necesario disponer de un método que permita realizar esta operación de ajuste de un modo fácil y sistemático.
Para ajustar reacciones de óxidación-reducción (redox) se tiene como fundamento el principio de la conservación de la carga eléctrica. Esto es, en una reacción redox de transferencia de los electrones se tiene que:
|
Hay dos métodos de ajustes de las reacciones redox: el del número de oxidación, y el de ión-electrón. El primero es útil porque se centra en los cambios químicos involucrados, mientras que el de ión-electrón es útil porque se focaliza en la transferencia de electrones.
Antes de proceder al ajuste de una reacción redox se debe disponer de una reacción escrita en forma cualitativa y completa,con todos sus reaccionantes y productos.
Método del número de oxidación
Es el método más conveniente a emplear para reacciones redox entre sustancias moleculares, covalentes como las que suelen darse en fase gaseosa.
La clave del método del número de oxidación (nox) para el ajuste (también llamado balanceo) es tener en cuanta que el cambio en el total de todos los números de oxidación debe ser cero. Esto es, que los incrementos del nox del oxidante y del reductor deben anularse entre si al sumar los algebraicamente para de este modo cumplir con el principio de conservación de la carga eléctrica. Esto es un incremento en el número de oxidación para el átomo oxidado debe compensarse con una disminución en el nox del átomo reducido.
Los pasos a dar para ajustar una reacción redox con este método son los siguientes:
1.- Se escribe la ecuación de la reacción redox a ajustar. Se ajusta la ecuación para todos los átomos que interviene en la misma utilizando los coeficientes estequiométricos apropiados.
2. Se escribe encima del símbolo de cada elemento su número de oxidación, y se identifica los elementos que han cambiado su nox i.e. el oxidante y al reductor en la reacción .
3.- Hay que encontrar el neto incremento de nox de los átomos que sufren oxidación y el descenso neto del número de oxidación de los elementos que se han reducido. Así, para el oxidante se extrae su símbolo y se escribe su nox en sus dos estados, como reaccionate y como producto. Lo mismo se hace tonel reductor.
4.- Se multiplican ambos incrementos por los números convenientes para igualar el valor absoluto de sus cargas (que será el mínimo común múltiplo a ambos incrementos) de tal manera que ambos incrementos sean iguales. A continuación , oxidante y reductor intercambian sus multiplicadores y se comprueba que quedan ajustadas sus variaciones de carga en la reacción.
5.- Los multiplicadores se introducen ahora como coeficientes. Teniendo en cuenta que lo importante es el número de átomos del elemento considerado, y que por lo tanto, los coeficientes pueden ser suplidos por subíndices, cuando los hay en la formula correspondiente.
6.- Finalmente, se ajusta el coeficiente de aquellas sustancias cuyo elementos no han participado en el proceso redox pero si en la reacción global. El agua suele serla molécula más frecuente en ser ajustada
Ejemplo de aplicación de estas reglas:
El ácido nítrico 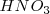 reacciona con el ácido bromhídrico
reacciona con el ácido bromhídrico 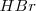 para dar bromo libre (
para dar bromo libre (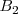 , monóxido de nitrógeno
, monóxido de nitrógeno 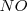 y agua
y agua 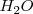 .
.
El ajuste de esta reacción redox se realizaría de la siguiente manera siguiendo los pasos del método del número de oxidación.
Se escribe en primer lugar la ecuación de la reacción en forma solo cualitativa (sin ajustar):
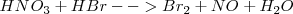
1. Se anotan los nox de cada elemento (incluidos entre paréntesis) y se identifica a continuación el elemento oxidante (que sufre una reducción) y el reductor (que sufre oxidación).
2 y 3. Se extraen por separado los procesos atómicos de oxidación y reducción:
3. Se igualan los incrementos multiplicando la reducción por 2 y la oxidación por 3:
4.- Los coeficientes atómicos moleculares obtenidos enel paso anterior se introducen como coeficientes en la reacción:

5. Finalmente hay que ajustar el número de moléculas de agua que stan sin ajustar. El coeficiente estequiométrico del agua 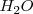 viene determinado por el contenido de H y O de los reactivos ya ajustados:
viene determinado por el contenido de H y O de los reactivos ya ajustados:
Esto es:
Reacción redox ajustada
El ajuste se ha terminado, pero hay que tener el hábito de comprobar que este se ha ealizado de manera correcta contando los los átomos de cada elemento en las sustancias reaccionantes y en los productos de la reacción.