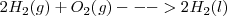Reversibilidad de las reacciones químicas. Segundo principio de la Termodinámica
De Wikillerato
En la naturaleza algunos procesos ocurren espontáneamente, por ejemplo un gas se expande hasta llenar todo el recipiente que lo continene, pero el gas en esa situación no se contrae súbitamente en un volumen más pequeño. Un objeto caliente se enfría a la temperatura de sus alrededores, pero nunca se observa que un objeto fría aparezca súbitamente más caliente que su entorno. El hidrógeno y el oxígeno se pueden combinar explosivamente (una vez que una chispa haya liberado su capacidad para hacerlo) para formar agua, pero el agua que compone los océanos, lagos y mares de la Tierra no se descompone gradualmente en hidrógeno y agua.
Estas observaciones sugieren que los cambios naturales pueden dividirse en dos clases:
Espontáneo: un cambio que tiene tendencia a ocurrir sin que sea necesaria la intervención exterior (en forma de trabajo).
Por ejemplo la combinación de hidrógeno en presencia de platino como catalizador
La reacción en sentido directo ocurre espontáneamente, pero la reacción inversa, la descomposición del agua en sus elementos no ocurre espontáneamente independientemente del tiempo que esperemos para que ello ocurra.
No espontáneo: aquel que se realiza solo si es “instigado” haciendo trabajo desde el exterior. Por ejemplo un gas puede ser comprimido por un pistón obligándolo a que ocupe menos volumen. Un objeto frío puede ser calentado por un calentador eléctrico. El agua puede ser descompuesta en hidrógeno y oxígeno por el pasaje de una corriente eléctrica (electrolisis).
La termodinámica trata con la tendencia al cambio, pero no dice nada de la tasa o velocidad en la cual esa tendencia es realizada. Así, algunos cambios espontáneos son muy rápidos tales como la reacción de precipitación que ocurre cuando soluciones de sal común 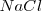 y nitrato de plata (
y nitrato de plata (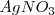 ) son mezcladas. Sin embargo, algunos cambios espontáneos son tan lentos que no hay un cambio observable después de millones de años. Por ejemplo aunque la descomposición del benceno en carbón e hidrógeno es espontánea, no ocurre en una tasa medible bajo condiciones normales.
) son mezcladas. Sin embargo, algunos cambios espontáneos son tan lentos que no hay un cambio observable después de millones de años. Por ejemplo aunque la descomposición del benceno en carbón e hidrógeno es espontánea, no ocurre en una tasa medible bajo condiciones normales.
Una reacción exotérmica ( 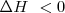 ) puede producirse espontáneamente por encontrar una situación más estable. Pero existen reacciones exotérmicas que no están de acuerdo con este criterio y otras endotérmicas que se producen de forma espontánea aunque sean endotérmicas, tal es el caso de la disolución de la sal común en agua. El hielo por ejemplo puede absorber espontáneamente calor del entorno y descongerlarse a temperaturas por encima del ºC. El gas
) puede producirse espontáneamente por encontrar una situación más estable. Pero existen reacciones exotérmicas que no están de acuerdo con este criterio y otras endotérmicas que se producen de forma espontánea aunque sean endotérmicas, tal es el caso de la disolución de la sal común en agua. El hielo por ejemplo puede absorber espontáneamente calor del entorno y descongerlarse a temperaturas por encima del ºC. El gas 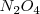 absorbe calor se descompone a
absorbe calor se descompone a 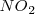 a 400 K .
a 400 K .
[Unparseable or potentially dangerous latex formula. Error 3 ] [Unparseable or potentially dangerous latex formula. Error 3 ] [Unparseable or potentially dangerous latex formula. Error 3 ] </math> \Delta H^o\ = +57,1 kJ </math>\Delta H^o\ = +3,88 kJ </math>
Todos estos procesos son endotérmicos, aunque todos son espontáneos. En todos los casos, el sistema se mueve espontáneamente a un estado de “más alta” energía potencial absorbiendo calor de sus alrededores.
Ya que algunas reacciones espontáneas son exotérmicas y otras endotérmicas la entalpía sola no puede dar cuenta para la dirección del cambio espontáneo, un segundo factor debe estar involucrado. Ese factor es la entropía, que relacionada adecuadamente con la entalpía, nos permite encontrar un criterio adecuado para estudiar la espontaneidad de un proceso o una reacción química.
Tweet