Teoría atómica de Dalton
De Wikillerato
Las leyes de las transformaciones química anteriormente enunciadas resumen un gran número de hechos experimentales que conciernen a los aspectos cuantitativos de las reacciones químicas ¿como se pueden explicar dichas leyes? Como racionalizar esas leyes a la luz de una teoría sobre la composición última de la materia?
Fue John Dalton (1766-1844) un científico inglés quien propuso una teoría atómica funcional a comienzos del siglo XIX que iba más allá de las propuestas especulativas de los filósofos griegos y que teniendo como base para su propuesta atómica el conjunto de observaciones empíricas realizadas a lo largo del siglo XVIII que como hemos visto habían sido resumidas en la leyes químicas anteriormente enunciadas. Publicó sus ideas en el trabajo titulado A New System of Chemical Phylosphy (Un Nuevo Sistema de Filosofía Química) el cual contenía una serie de importantes postulados:
1.- Todos los elementos consisten de átomos, los cuales no pueden ser divididos por métodos químicos. Utilizó en vocablo átomo en recuerdo de la vieja idea atomísta de Leucipo y Demócrito. Aunque Dalton no conocía la naturaleza final de los átomos (los cuales por su pequeño tamaño eran “invisibles”, el consideraba que los mismos podrían explicar de manera sencilla la diversidad existente de elementos y compuestos detectados y estudiados por la química hasta la fecha.
2.- Todos los átomos del mismo elemento químico tienen igual tamaño, masa y cualidad, pero difieren en esos aspectos de los átomos de otros elementos. Esto significa que todas las propiedades de los elementos químicos está determinada por las de sus átomos. Dalton se dio cuenta así de que debe haber algún rasgo que distingue a un elemento de otro, debido a que la ley de proporciones definidas de Proust se combina en ratios de masa específicas, Dalton razonó que la masa debe ser una cantidad que distingue unos átomo de otros.
Cuando un elemento químico A reacciona para formar un compuesto 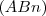 (n=1,2,3) cada átomo de A se combina con uno o varios átomos de B y por tanto el número de ratio
(n=1,2,3) cada átomo de A se combina con uno o varios átomos de B y por tanto el número de ratio 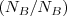 es siempre un número entero. Fracciones de átomos nunca están involucradas en la reacciones químicas.
es siempre un número entero. Fracciones de átomos nunca están involucradas en la reacciones químicas.
3.- Una reacción química es una reacción de separación o de unión entre átomos. Así una reacción química es solo un reordenamiento de la manera en la que los átomos son combinados, los átomos en si mismos permanecen sin cambiar. Con este postulado Dalton se daba cuenta de que los átomos deben ser químicamente indestructibles para que la ley de laconservaciónde la masa se válida. Si el mismo número de átomos y case de átomos están presentes en ambos los reactivos y los productos de una reacción química. Entonces la masa de los reactivos debe ser igual a la de los productos.
Bibliografía
Enlaces externos
Tweet


