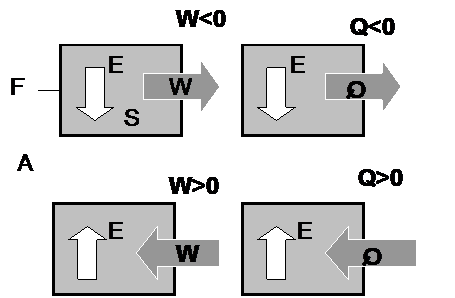
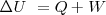Convenio de signos en las transformaciones termodinámicas
De Wikillerato
(Página nueva: Criterios convencional de signos en las transformaciones Termodinámicas: El primer principio de la termodinámica se expres en terminos matemáticos en la siguiente ecuación: ...) |
|||
| (Una edición intermedia no se muestra.) | |||
| Línea 5: | Línea 5: | ||
<math> \Delta U\ = Q + W </math> | <math> \Delta U\ = Q + W </math> | ||
| - | El cambio en la energía interna <math> U </math> de un sistema está | + | El cambio en la energía interna <math> U </math> de un sistema está relacionada con la energía que intercambia con su entorno, en forma de calor, y con el trabajo <math>W</math> que el sistema realiza sobre los alrededores o el sistema sobre este. |
| - | El signo <math> + </math> y <math> - </math> depende si al transferir energía al sistema | + | El signo <math> + </math> y <math> - </math> depende si al transferir energía al sistema como calor <math>Q</math> o como trabajo <math>W </math> la energía interna <math> U </math> del sistema aumenta o no, así : |
<math>Q > 0 </math> , i.e. <math>Q</math> es positivo <math>+ </math>, si se tranfiere calor al sistema, aumentando con ello su energía interna. | <math>Q > 0 </math> , i.e. <math>Q</math> es positivo <math>+ </math>, si se tranfiere calor al sistema, aumentando con ello su energía interna. | ||
| - | <math>Q <0 </math>, i.e. <math>Q</math> negativo <math> - </math>, si el sistema cede calor al entorno | + | <math>Q <0 </math>, i.e. <math>Q</math> negativo <math> - </math>, si el sistema cede calor al entorno exterior, disminuyendo con ello su enería interna. |
<math> W > 0 </math>,i.e. <math>W</math> positivo <math> + </math>, si se realiza trabajo sobre el sistema, aumentando así su enegía interna. | <math> W > 0 </math>,i.e. <math>W</math> positivo <math> + </math>, si se realiza trabajo sobre el sistema, aumentando así su enegía interna. | ||
| Línea 17: | Línea 17: | ||
<math> W<0 </math>, i.e. <math>W</math>negativo<math>-</math>, si el sistem realiza trabjo sobre el exterior, disminuyendo con ello su energía interna. | <math> W<0 </math>, i.e. <math>W</math>negativo<math>-</math>, si el sistem realiza trabjo sobre el exterior, disminuyendo con ello su energía interna. | ||
| - | + | [[Imagen:Convenio_de_Signos.gif]] | |
| - | + | Teniendo este convenio de signos en cuenta, se escribe <math>Q=-100 J</math> si <math>100 J (julios)</math> de enegía dejan el sistema pra calentar sus alrededores, mientras que <math>Q= +100J </math> si <math> 100 J </math> de energía en el sistema cuando es calentdo por el entorno exerior. | |
| - | La convención de signos es | + | Por otra parte cuando un sistema hace trabajo la energía transferida es cuantificada como negativa. Por ejemplo si un sistema realiza trabajo al levantar un peso hacia los alrededores y en el proceso <math> 100 J </math> de energía son requeridos (esto es <math>100 J </math> de enegía dejan el sistema haciendo trabajo), entonces se escribe <math>W = -100J </math>. Cuando el trabajo es realiado sobre el sistema (por ejmplo al campr gas en un cilindro, <math>W</math> es considerado como negativo, así si se han invertido <math>100J</math> en el trabajo hecho sobre el sistema habra sido de <math>W= + 100 J</math> , esto es <math>100J</math> energía han sido transferidos al sistema haciendo trabajo. |
| + | |||
| + | La convención de signos es fácil de seguir si se piensa en la situación final de la energía interna del sistema, si la energía decrece <math>Q</math> y <math>W</math> son negativos, por el contrario si la energía interna se incrementa <math>Q</math> y <math>W</math> son positivos. | ||
[[Categoría: Química]] | [[Categoría: Química]] | ||
Revisión actual
Criterios convencional de signos en las transformaciones Termodinámicas:
El primer principio de la termodinámica se expres en terminos matemáticos en la siguiente ecuación:
El cambio en la energía interna 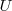 de un sistema está relacionada con la energía que intercambia con su entorno, en forma de calor, y con el trabajo
de un sistema está relacionada con la energía que intercambia con su entorno, en forma de calor, y con el trabajo 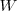 que el sistema realiza sobre los alrededores o el sistema sobre este.
que el sistema realiza sobre los alrededores o el sistema sobre este.
El signo  y
y  depende si al transferir energía al sistema como calor
depende si al transferir energía al sistema como calor 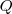 o como trabajo
o como trabajo 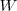 la energía interna
la energía interna 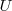 del sistema aumenta o no, así :
del sistema aumenta o no, así :
, i.e.
es positivo
, si se tranfiere calor al sistema, aumentando con ello su energía interna.
, i.e.
negativo
, si el sistema cede calor al entorno exterior, disminuyendo con ello su enería interna.
,i.e.
positivo
, si se realiza trabajo sobre el sistema, aumentando así su enegía interna.
, i.e.
negativo
, si el sistem realiza trabjo sobre el exterior, disminuyendo con ello su energía interna.
Teniendo este convenio de signos en cuenta, se escribe 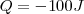 si
si 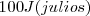 de enegía dejan el sistema pra calentar sus alrededores, mientras que
de enegía dejan el sistema pra calentar sus alrededores, mientras que 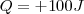 si
si 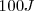 de energía en el sistema cuando es calentdo por el entorno exerior.
de energía en el sistema cuando es calentdo por el entorno exerior.
Por otra parte cuando un sistema hace trabajo la energía transferida es cuantificada como negativa. Por ejemplo si un sistema realiza trabajo al levantar un peso hacia los alrededores y en el proceso 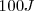 de energía son requeridos (esto es
de energía son requeridos (esto es 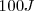 de enegía dejan el sistema haciendo trabajo), entonces se escribe
de enegía dejan el sistema haciendo trabajo), entonces se escribe  . Cuando el trabajo es realiado sobre el sistema (por ejmplo al campr gas en un cilindro,
. Cuando el trabajo es realiado sobre el sistema (por ejmplo al campr gas en un cilindro, 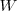 es considerado como negativo, así si se han invertido
es considerado como negativo, así si se han invertido 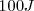 en el trabajo hecho sobre el sistema habra sido de
en el trabajo hecho sobre el sistema habra sido de  , esto es
, esto es 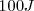 energía han sido transferidos al sistema haciendo trabajo.
energía han sido transferidos al sistema haciendo trabajo.
La convención de signos es fácil de seguir si se piensa en la situación final de la energía interna del sistema, si la energía decrece 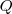 y
y 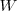 son negativos, por el contrario si la energía interna se incrementa
son negativos, por el contrario si la energía interna se incrementa 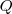 y
y 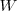 son positivos.
son positivos.