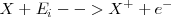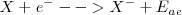Energía de ionización. Afinidad electrónica
De Wikillerato
(→Energía de ionización) |
|||
| (4 ediciones intermedias no se muestran.) | |||
| Línea 7: | Línea 7: | ||
<math> X + E_i --> X^+ + e^- </math> | <math> X + E_i --> X^+ + e^- </math> | ||
| - | de átomos. | + | |
| + | La energía de ionización se mide en [[electrón-voltios]] (eV) para el átomo aislado y en kJ )kilojulios)para un mol de átomos. | ||
Por ejemplo para el átomo de hidrógeno son necesarios 1312.0 kJ/mol. | Por ejemplo para el átomo de hidrógeno son necesarios 1312.0 kJ/mol. | ||
| + | En una gráfica en la que se representa el número atómico versus la energía de ionización (kJ/mol) la <math>E_i </math> varia de una manera amplia, desde el valor bajo del cesio (375.5 kJ/mol) a un valor de 2372.3 kJ/mol para el helio. Se observa también una clara peridicidad en los datos. Los valores mínimos de <math< E_i </math> corresponden a los elementos del grupo 8A (gases nobles) y la energía de ionización se incrementa gradualmente desde la izquierda a derecha en la tabla periódica, por ejemplo desde el sodio (Na) al argón (Ar). Los valores son siempre positivos indicando que la energía siempre es requerida para extraer un electrón de un átomo. | ||
| + | |||
| + | En la tabla periódica, la energía de ionización disminuye al bajar en un grupo porque en este sentido aumenta el número de [[capas electrónicas]] y con ello el apantallamiento del núcleo frente al electrón a extraer. | ||
Al aumentar el número atómico dentro de un periodo, la energía de ionización aumenta porque aumenta el número de protones del núcleo sin que aumente el número de capas, con lo que el apantallamiento permanece prácticamente constante. | Al aumentar el número atómico dentro de un periodo, la energía de ionización aumenta porque aumenta el número de protones del núcleo sin que aumente el número de capas, con lo que el apantallamiento permanece prácticamente constante. | ||
Revisión actual
Energía de ionización
La energía de ionización se define como:
|
Es un proceso endotérmico que se puede representar así:
La energía de ionización se mide en electrón-voltios (eV) para el átomo aislado y en kJ )kilojulios)para un mol de átomos.
Por ejemplo para el átomo de hidrógeno son necesarios 1312.0 kJ/mol.
En una gráfica en la que se representa el número atómico versus la energía de ionización (kJ/mol) la 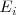 varia de una manera amplia, desde el valor bajo del cesio (375.5 kJ/mol) a un valor de 2372.3 kJ/mol para el helio. Se observa también una clara peridicidad en los datos. Los valores mínimos de <math< E_i </math> corresponden a los elementos del grupo 8A (gases nobles) y la energía de ionización se incrementa gradualmente desde la izquierda a derecha en la tabla periódica, por ejemplo desde el sodio (Na) al argón (Ar). Los valores son siempre positivos indicando que la energía siempre es requerida para extraer un electrón de un átomo.
varia de una manera amplia, desde el valor bajo del cesio (375.5 kJ/mol) a un valor de 2372.3 kJ/mol para el helio. Se observa también una clara peridicidad en los datos. Los valores mínimos de <math< E_i </math> corresponden a los elementos del grupo 8A (gases nobles) y la energía de ionización se incrementa gradualmente desde la izquierda a derecha en la tabla periódica, por ejemplo desde el sodio (Na) al argón (Ar). Los valores son siempre positivos indicando que la energía siempre es requerida para extraer un electrón de un átomo.
En la tabla periódica, la energía de ionización disminuye al bajar en un grupo porque en este sentido aumenta el número de capas electrónicas y con ello el apantallamiento del núcleo frente al electrón a extraer.
Al aumentar el número atómico dentro de un periodo, la energía de ionización aumenta porque aumenta el número de protones del núcleo sin que aumente el número de capas, con lo que el apantallamiento permanece prácticamente constante.
La ionización no está limitada a la extracción de un único electrón en un átomo. Dos o tres o más electrones pueden ser removidos secuencialmente de un átomo, y la cantidad de energía en cada etapa puede ser cuantificada.
 Primera energía de ionización
Primera energía de ionización 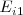
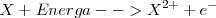 Segunda energía de ionización
Segunda energía de ionización 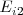
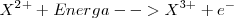 Tercera energía de ionización
Tercera energía de ionización 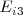
Y así sucesivamente
La segunda energía de ionización (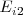 , que supone la extracción del segundo electrón, es superior a la primera porque el átomo se ha convertido previamente en un catión (con carga positiva) y su atracción por el electrón será mayor oponiendo mayor resistencia a su extracción. Esto es, es más difícil extraer un electrón de un ión cargado positivamente (e.g.
, que supone la extracción del segundo electrón, es superior a la primera porque el átomo se ha convertido previamente en un catión (con carga positiva) y su atracción por el electrón será mayor oponiendo mayor resistencia a su extracción. Esto es, es más difícil extraer un electrón de un ión cargado positivamente (e.g. 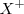 que de un átomo neutro (
que de un átomo neutro (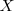 ).
).
El valor de la energía de ionización está fuertemente condicionado por el tipo de configuración electrónica que se destruye al arrancar el electrón. Por ejemplo la segunda energía de ionización 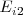 de los metales alcalinos es relativamente mayor que la de otros elementos porque supone la destrucción del octeto de la penúltima capa, el cual es especialmente estable. Por ello las diferencias de energía de ionización para sucesivas etapas de extracción electrónica varia enormemente de un elemento a otro. Por ejemplo la extracción del segundo electrón del ión sodio (
de los metales alcalinos es relativamente mayor que la de otros elementos porque supone la destrucción del octeto de la penúltima capa, el cual es especialmente estable. Por ello las diferencias de energía de ionización para sucesivas etapas de extracción electrónica varia enormemente de un elemento a otro. Por ejemplo la extracción del segundo electrón del ión sodio (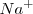 ) requiere diez veces más de energía que para remover el primero del átomo neutro de sodio (
) requiere diez veces más de energía que para remover el primero del átomo neutro de sodio (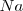 ) (4562 versus 496 kJ/mol), pero la extracción del segundo electrón del magnesio requiere solo dos veces más de energía que el primero (1451 versus 738 kJ/mol).
) (4562 versus 496 kJ/mol), pero la extracción del segundo electrón del magnesio requiere solo dos veces más de energía que el primero (1451 versus 738 kJ/mol).
Afinidad electrónica
La afinidad electrónica (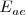 ) es el cambio energético que ocurre cuando un átomo capta un electrón para convertirse en un anión. Es por ello el fenómeno opuesto a la ionización electrónica:
) es el cambio energético que ocurre cuando un átomo capta un electrón para convertirse en un anión. Es por ello el fenómeno opuesto a la ionización electrónica:
Es un proceso generalmente exotérmico. Así mientras que las energía de ionización son siempre positivas, debido a que una energía debe ser suministrada para extraer el electrón, las afinidades electrónicas son generalmente positivas debido a que la energía es liberada cuando a un átomo neutro se le añade un electrón.
Cuanto más negativa sea la energía 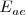 más grande es la tendencia de un átomo a aceptar un electrón y más estable será el anión que resulta. Por ejemplo, la
más grande es la tendencia de un átomo a aceptar un electrón y más estable será el anión que resulta. Por ejemplo, la 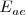 del hidrógeno es de -72.8 kJ/mol, lo que significa que dicha energía es liberada formándose un anión
del hidrógeno es de -72.8 kJ/mol, lo que significa que dicha energía es liberada formándose un anión 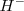 estable.
estable.
Como con la energía de ionización, las afinidades electrónicas muestran una periodicidad que está relacionada con la configuración de los elementos. El valor de la finidad electrónica para un elemento es debido a la interrelación de varios factores contrapuestos. Así, la atracción entre los electrones adicionales y el núcleo favorecen valores de 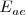 más negativos, pero un incremento en las repulsión electrón-electrón que resulta de la adición de un electrón extra favorece valores positivos de
más negativos, pero un incremento en las repulsión electrón-electrón que resulta de la adición de un electrón extra favorece valores positivos de 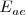 . Por ello, en la tabla periódica la afinidad electrónica disminuye conforme se desciende por el mismo por razón del mayor apantallamiento que proporcionan las capas electrónicas en número creciente. Por otra parte a lo largo de un periodo la afinidad electrónica aumenta debido al aumento de la carga del núcleo con igualdad del número de capas electrónicas.
. Por ello, en la tabla periódica la afinidad electrónica disminuye conforme se desciende por el mismo por razón del mayor apantallamiento que proporcionan las capas electrónicas en número creciente. Por otra parte a lo largo de un periodo la afinidad electrónica aumenta debido al aumento de la carga del núcleo con igualdad del número de capas electrónicas.
La afinidades electrónicas las grandes (con mayor valor negativo) la tiene los halógenos (F, Cl, Br, I) debido a que cada uno de estos elementos tienen un alta 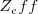 y un hueco en su capa de valencia para admitir un nuevo electrón. Los aniones de estos elementos que se forman tienen una configuración de gas noble con los subniveles
y un hueco en su capa de valencia para admitir un nuevo electrón. Los aniones de estos elementos que se forman tienen una configuración de gas noble con los subniveles  y
y 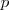 rellenos y la atracción entre el electrón adicional y el núcleo atómico es alta. Por otra parte valores positivos de
rellenos y la atracción entre el electrón adicional y el núcleo atómico es alta. Por otra parte valores positivos de 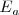 se encuentra en los gases nobles (He, Ne, Ar, Kr, Xe) debido a que los subniveles
se encuentra en los gases nobles (He, Ne, Ar, Kr, Xe) debido a que los subniveles 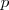 en estos niveles están completos, y el electrón adicional debe ir a la capa de un nivel más alto, donde es apantallado del núcleo y experimenta una
en estos niveles están completos, y el electrón adicional debe ir a la capa de un nivel más alto, donde es apantallado del núcleo y experimenta una 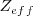 relativamente baja.
relativamente baja.
Por ello la atracción del núcleo en este caso al electrón añadido es por lo tanto pequeña y es sobrepasada por las repulsiones electrón-electrón adicionales.
Un halógeno: 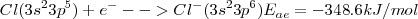
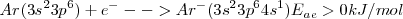 Tweet
Tweet


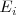 .
.