Entalpías de reacción
De Wikillerato
(→Entalpía de formación estándar) |
(→Entalpía de reacción estándar) |
||
| (9 ediciones intermedias no se muestran.) | |||
| Línea 2: | Línea 2: | ||
=== Entalpía de reacción estándar=== | === Entalpía de reacción estándar=== | ||
| - | + | ||
| + | La energía de reacción estándar (representada por Δ''H''<sub>r</sub><sup>O</sup> ) es la diferencia entre la entalpía molar estándar de los reactivos y de los productos, con cada término de la reacción siendo balanceado con su coeficiente estequiométrico apropiado <math> n </math> | ||
| + | |||
| + | Δ''H''<sub>r</sub><sup>O</sup>=ΣΔ''H''<sub>m</sub><sup>O</sup> (productos)- Δn''H''<sub>m</sub><sup>O</sup>(reactivos) | ||
| + | |||
| + | Donde la letra griega sigma mayúscula <math> \Sigma\ </math>, denota una suma, Δ''H''<sub>r</sub><sup>O</sup>, la variación de la entalpía de reacción estándar y Δ''H''<sub>m</sub><sup>O</sup> , la entalpía molar estándar de los reactivos y de los productos. | ||
| + | |||
| + | Debido a que <math> H </math> son cantidades molares (entalpía molar) y los coeficientes estequiométricos son números puros, las unidades de Δ''H''<sub>m</sub><sup>O</sup> son kilojulios (kJ) por mol. | ||
| + | |||
| + | La '''entalpía de reacción estándar''' es cambio de entalpía (energái intercambiada como calor) cuando los reactivos y los productos están en estado estándar (puros) son convertidos en en sus estados esándar, con el cambio expresado en kilojulios por mol </math>kJ/ml mth> tal como la reacción está escrita. | ||
| + | |||
[[Imagen:Diagrama_Entalpico_2.gif]] | [[Imagen:Diagrama_Entalpico_2.gif]] | ||
| Línea 9: | Línea 19: | ||
=== Entalpía de formación estándar === | === Entalpía de formación estándar === | ||
| - | + | La entalpía de reacción estándar (representada por Δ''H''<sub>f</sub><sup>O</sup>) de formación (f), es el cambio de entalpía que acompaña a la formación de un mol compuesto en su [[estado estándar]] a partir de sus constituyentes elementales también en su estados estándar. | |
| + | |||
| + | El estado estándar de un elemento es la forma más estable termodinámicamente a una temperatura de <math>25º C (298K) </math> y una presión de <math>1.00 x 10^5 Pascales (Pa) = 1 atm </math> . Algunos ejemplos de estados estándar de los elementos bajo las condiciones estándar son: | ||
| - | + | Hidrógeno: <math>H_2 (g) </math> | |
| + | Oxígeno: <math>O_2 (g) </math> | ||
Nitrógeno: <math> N_2 </math> | Nitrógeno: <math> N_2 </math> | ||
Bromo: <math>Br_2 </math> | Bromo: <math>Br_2 </math> | ||
| Línea 23: | Línea 36: | ||
Δ''H''<sub>f</sub><sup>O</sup> = 0 y ΔH<sub>f</sub><sup>O</sup> = 0 1,88 kJ/mol </math>) | Δ''H''<sub>f</sub><sup>O</sup> = 0 y ΔH<sub>f</sub><sup>O</sup> = 0 1,88 kJ/mol </math>) | ||
| - | Por definición, la entalpía estándar de formación de un elemento es su estado estándar es <math> 0 kJ/mol </math> | + | Por definición, la entalpía estándar de formación de un elemento es su estado estándar es <math> 0 kJ/mol </math> |
=== Entalpía de combustión === | === Entalpía de combustión === | ||
| - | + | La entalpía normal de combustión de una sustancia es la variación | |
| + | de entalpía de la reacción en la que un mol de la sustancia reacciona | ||
| + | con O2 | ||
| + | para producir dióxido de carbono y agua líquida | ||
=== Entalpía de enlace o de disociación === | === Entalpía de enlace o de disociación === | ||
| - | el | + | ETALPÍA DE ENLACE (energía de disociacion de enlace): |
| + | Es el calor necesario para mantener dos elementos unidos al formar un compuesto. | ||
| + | Al unirse los átomos aislados formandose un enlace covalente se libera energía y para separar los átomos unidos por enlaces covalentes se debe absorber energía. La energía de disociación del enlace, D, es la cantidad de energía necesaria para romper un mol de enlaces covalentes en una especie gaseosa. Las unidades SI son kilojulios por mol de enlaces (kj/mol) | ||
=== Entalpía de disolución=== | === Entalpía de disolución=== | ||
| - | |||
=== Entalpía de cambio de estado === | === Entalpía de cambio de estado === | ||
Revisión actual
La entalpía de reacción, que representa la variación de energía de la reacción, es la energía intercambiada en forma de calor con el entorno cuando se produce una reacción a presión constante. Se mide en 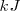 o en
o en 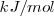 de la reacción tal como está escrita su ecuación química, o respecto a alguno de los compuestos que intervienen en la reacción.
de la reacción tal como está escrita su ecuación química, o respecto a alguno de los compuestos que intervienen en la reacción.
Tabla de contenidos |
Entalpía de reacción estándar
La energía de reacción estándar (representada por ΔHrO ) es la diferencia entre la entalpía molar estándar de los reactivos y de los productos, con cada término de la reacción siendo balanceado con su coeficiente estequiométrico apropiado 
ΔHrO=ΣΔHmO (productos)- ΔnHmO(reactivos)
Donde la letra griega sigma mayúscula 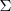 , denota una suma, ΔHrO, la variación de la entalpía de reacción estándar y ΔHmO , la entalpía molar estándar de los reactivos y de los productos.
, denota una suma, ΔHrO, la variación de la entalpía de reacción estándar y ΔHmO , la entalpía molar estándar de los reactivos y de los productos.
Debido a que 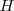 son cantidades molares (entalpía molar) y los coeficientes estequiométricos son números puros, las unidades de ΔHmO son kilojulios (kJ) por mol.
son cantidades molares (entalpía molar) y los coeficientes estequiométricos son números puros, las unidades de ΔHmO son kilojulios (kJ) por mol.
La entalpía de reacción estándar es cambio de entalpía (energái intercambiada como calor) cuando los reactivos y los productos están en estado estándar (puros) son convertidos en en sus estados esándar, con el cambio expresado en kilojulios por mol </math>kJ/ml mth> tal como la reacción está escrita.
Según el tipo de proceso físico-químico tendremos un distinto tipo de entalpía:
Entalpía de formación estándar
La entalpía de reacción estándar (representada por ΔHfO) de formación (f), es el cambio de entalpía que acompaña a la formación de un mol compuesto en su estado estándar a partir de sus constituyentes elementales también en su estados estándar.
El estado estándar de un elemento es la forma más estable termodinámicamente a una temperatura de 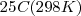 y una presión de
y una presión de 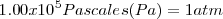 . Algunos ejemplos de estados estándar de los elementos bajo las condiciones estándar son:
. Algunos ejemplos de estados estándar de los elementos bajo las condiciones estándar son:
Hidrógeno: 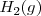 Oxígeno:
Oxígeno: 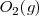 Nitrógeno:
Nitrógeno: 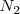 Bromo:
Bromo: 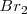 Hierro:
Hierro: 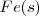 Cobre:
Cobre: 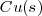 Mercurio:
Mercurio: 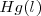 Carbon: C (grafito) </math>
Azufre:
Carbon: C (grafito) </math>
Azufre: 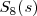
Donde 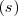 es la abreviatura de sólido;
es la abreviatura de sólido; 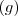 de gas y
de gas y 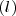 de líquido. No hay que confundir el estado de referencia con estado estándar, así el estado de referencia del carbono a 25 ºC es el grafito no el diamante. Sus entalpías normales de formación respectivas son:
ΔHfO = 0 y ΔHfO = 0 1,88 kJ/mol </math>)
de líquido. No hay que confundir el estado de referencia con estado estándar, así el estado de referencia del carbono a 25 ºC es el grafito no el diamante. Sus entalpías normales de formación respectivas son:
ΔHfO = 0 y ΔHfO = 0 1,88 kJ/mol </math>)
Por definición, la entalpía estándar de formación de un elemento es su estado estándar es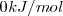
Entalpía de combustión
La entalpía normal de combustión de una sustancia es la variación de entalpía de la reacción en la que un mol de la sustancia reacciona con O2 para producir dióxido de carbono y agua líquida
Entalpía de enlace o de disociación
ETALPÍA DE ENLACE (energía de disociacion de enlace): Es el calor necesario para mantener dos elementos unidos al formar un compuesto. Al unirse los átomos aislados formandose un enlace covalente se libera energía y para separar los átomos unidos por enlaces covalentes se debe absorber energía. La energía de disociación del enlace, D, es la cantidad de energía necesaria para romper un mol de enlaces covalentes en una especie gaseosa. Las unidades SI son kilojulios por mol de enlaces (kj/mol)




