Enlace iónico
De Wikillerato
| (5 ediciones intermedias no se muestran.) | |||
| Línea 1: | Línea 1: | ||
| + | ==Enlace iónico== | ||
| - | El '''enlace | + | El '''enlace iónico (o electrovalente)''' se forma por la transferencia de uno o más electrones de un átomo a otro. Transferencia que conduce a la creación de átomos con carga (iones) de distinto signo (cationes de signo positivo y aniones de signo negativo) que se ''atraen electrostáticamente'' por acción de la [[fuerza eléctrica]] quedando sujetos (unidos) entre si. La sustancia cristalina que resulta se denomina '''sólido iónico'''. |
| - | + | La formación de un ión partiendo de un átomo comporta la absorción o la emisión de energía, según el ión que se forme y el elemento que se trate. El ión formado tiene un tamaño que depende de la carga iónica y del átomo originario. | |
| + | Los compuestos formados por transferencia de electrones de un átomo a otro son llamados '''compuestos iónicos'''. El enlace iónico es un enlace débil, pero dado que en un cristal muchos de tales enlaces mantienen a un ión en su sitio dentro del cristal, hacen que la fuerza de este enlace sea más fuerte. | ||
| - | + | La unidad más pequeña de un compuesto iónico se denomina '''formula unidad''', ya queel compuesto es la combinación de iones pero no son moléculas discretas. Por ejemplo la fórmula unidad del cloruro de sodio <math>NaCl </math> consiste de un ión sodio (catión) y un ión cloro (anión). | |
| + | |||
| + | La formula unidad del óxido de sodio (<math>Na_2O </math>) se forma cuando 2 átomos de sodio transfieren un electrón cada uno a un átomo de oxigeno. Para que el átomo de oxígeno adquiera 8 electrones en su nivel energético más alto, debe ganar dos electrones, debido a que ya tiene 6 electrones de valencia. Esto requiere dos átomos de sodio debido a que cada átomo de sodio tiene solo un electrón de valencia para donar. Por lo tanto cada uno de los átomos de sodio transfiere su electrón de valencia al único átomo de oxígeno para formar la formula unidad <math>Na_2O</math>, que consiste en 2 iones de sodio positivos (cationes) y un ión oxido negativo (anión) formando un cristal de muchos iones entrelazados. La pérdida de un electrón del átomo de sodio resulta en <math> 1^+ </math> caga iónica del ión sodio, y la ganancia de dos electrones por el oxígeno resulta en una carga <math> 2^- </math> para el ión oxido. | ||
| + | |||
| + | Por ello, se define la ''electrovalencia'' de un ióncomo el número de cargas elementales que posee: la electrovalencia del sodio (Na) será <math> 1^+ </math>, la del cloro <math> 1^+ </math>, la del oxigeno <math> 2^- </math>. | ||
| + | |||
| + | [[Categoría: Química]] | ||
Revisión actual
Enlace iónico
El enlace iónico (o electrovalente) se forma por la transferencia de uno o más electrones de un átomo a otro. Transferencia que conduce a la creación de átomos con carga (iones) de distinto signo (cationes de signo positivo y aniones de signo negativo) que se atraen electrostáticamente por acción de la fuerza eléctrica quedando sujetos (unidos) entre si. La sustancia cristalina que resulta se denomina sólido iónico.
La formación de un ión partiendo de un átomo comporta la absorción o la emisión de energía, según el ión que se forme y el elemento que se trate. El ión formado tiene un tamaño que depende de la carga iónica y del átomo originario.
Los compuestos formados por transferencia de electrones de un átomo a otro son llamados compuestos iónicos. El enlace iónico es un enlace débil, pero dado que en un cristal muchos de tales enlaces mantienen a un ión en su sitio dentro del cristal, hacen que la fuerza de este enlace sea más fuerte.
La unidad más pequeña de un compuesto iónico se denomina formula unidad, ya queel compuesto es la combinación de iones pero no son moléculas discretas. Por ejemplo la fórmula unidad del cloruro de sodio 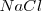 consiste de un ión sodio (catión) y un ión cloro (anión).
consiste de un ión sodio (catión) y un ión cloro (anión).
La formula unidad del óxido de sodio (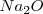 ) se forma cuando 2 átomos de sodio transfieren un electrón cada uno a un átomo de oxigeno. Para que el átomo de oxígeno adquiera 8 electrones en su nivel energético más alto, debe ganar dos electrones, debido a que ya tiene 6 electrones de valencia. Esto requiere dos átomos de sodio debido a que cada átomo de sodio tiene solo un electrón de valencia para donar. Por lo tanto cada uno de los átomos de sodio transfiere su electrón de valencia al único átomo de oxígeno para formar la formula unidad
) se forma cuando 2 átomos de sodio transfieren un electrón cada uno a un átomo de oxigeno. Para que el átomo de oxígeno adquiera 8 electrones en su nivel energético más alto, debe ganar dos electrones, debido a que ya tiene 6 electrones de valencia. Esto requiere dos átomos de sodio debido a que cada átomo de sodio tiene solo un electrón de valencia para donar. Por lo tanto cada uno de los átomos de sodio transfiere su electrón de valencia al único átomo de oxígeno para formar la formula unidad 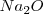 , que consiste en 2 iones de sodio positivos (cationes) y un ión oxido negativo (anión) formando un cristal de muchos iones entrelazados. La pérdida de un electrón del átomo de sodio resulta en
, que consiste en 2 iones de sodio positivos (cationes) y un ión oxido negativo (anión) formando un cristal de muchos iones entrelazados. La pérdida de un electrón del átomo de sodio resulta en 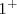 caga iónica del ión sodio, y la ganancia de dos electrones por el oxígeno resulta en una carga
caga iónica del ión sodio, y la ganancia de dos electrones por el oxígeno resulta en una carga 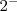 para el ión oxido.
para el ión oxido.
Por ello, se define la electrovalencia de un ióncomo el número de cargas elementales que posee: la electrovalencia del sodio (Na) será 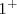 , la del cloro
, la del cloro 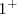 , la del oxigeno
, la del oxigeno 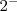 .
.



