Los espectros atómicos y las transiciones electrónicas
De Wikillerato
(Página nueva: <h4>Antecedentes históricos: Espectroscopia</h4> El hombre ha tenido a lo largo de su historia contacto con uno de los fenómenos naturales más bellos que se manifiesta en un día ...) |
|||
| Línea 1: | Línea 1: | ||
<h4>Antecedentes históricos: Espectroscopia</h4> | <h4>Antecedentes históricos: Espectroscopia</h4> | ||
| - | El hombre ha tenido a lo largo de su historia contacto con uno de los fenómenos naturales más bellos que se manifiesta en un día de Sol, pero con un algunas nubes que descargan lluvia, un maravilloso “arco iris” se puede visualizar en el cielo en el lado opuesto de Sol. Aunque debería estar claro que el fenómeno estaba ligado a la presencia conjunta de luz y agua, no se comenzó a tener una idea científica clara del fenómeno hasta que en el año 1666 el gran científico Isaac Newton (1643-1726) | + | El hombre ha tenido a lo largo de su historia contacto con uno de los fenómenos naturales más bellos que se manifiesta en un día de Sol, pero con un algunas nubes que descargan lluvia, un maravilloso “arco iris” se puede visualizar en el cielo en el lado opuesto de Sol. Aunque debería estar claro que el fenómeno estaba ligado a la presencia conjunta de luz y agua, no se comenzó a tener una idea científica clara del fenómeno hasta que en el año 1666 el gran científico Isaac Newton (1643-1726) pudo “descomponer” con un prisma de vidrio la luz blanca del Sol en los “siete” colores carasterístico de su “alma” o '''espectro''' y ''recomponer'' de nuevo el rayo de luz blanca a partir de sus colores con un segundo prisma. Newton había descubierto la dispersión de la luz por la materia, un aspecto que resultó esencial para la comprensión de la naturaleza física de la luz. Este experimento está descrito en su tratado de'' Óptica'' (''Opticks'' en latín) publicado en 1704. |
Hubo que esperar ciento cincuenta años hasta que en 1814, el físico alemán Joseph Von Fraunhofer (1787-1826) observara unas lineas o rayas oscuras (más de 600) en el espectro de la luz solar, [una observación anterior de lineas oscuras en 1802, fue realizada por el físico y químico británico William Wollaston (1766-1828)] que fueron interpretadas en 1859 por los también físicos alemanes Robert-Wilhelm Busen (1811-1899) y Gustav-Robert Kirchhoff (1824-1887) como absorciones de la luz por los átomos (en este particular caso por los gases situados en la atmósfera solar). | Hubo que esperar ciento cincuenta años hasta que en 1814, el físico alemán Joseph Von Fraunhofer (1787-1826) observara unas lineas o rayas oscuras (más de 600) en el espectro de la luz solar, [una observación anterior de lineas oscuras en 1802, fue realizada por el físico y químico británico William Wollaston (1766-1828)] que fueron interpretadas en 1859 por los también físicos alemanes Robert-Wilhelm Busen (1811-1899) y Gustav-Robert Kirchhoff (1824-1887) como absorciones de la luz por los átomos (en este particular caso por los gases situados en la atmósfera solar). | ||
| Línea 7: | Línea 7: | ||
Poco después un número de científicos observaron rayas brillantes muy estrechas y bien definidas en el espectro de la luz emitidas por llamas, arcos voltaicos y chispas. Había nacido la espectroscopia, el espectroscopio, el aparato que sirve para separar (analizar) los distintos componentes de una emisión lumínica en función de su longitud de onda (o frecuencia), que con una configuración experimental basada esencialmente en aquella introducida por Newton en el siglo XVII, se convertiría así en unos de los instrumentos esenciales de la física moderna. | Poco después un número de científicos observaron rayas brillantes muy estrechas y bien definidas en el espectro de la luz emitidas por llamas, arcos voltaicos y chispas. Había nacido la espectroscopia, el espectroscopio, el aparato que sirve para separar (analizar) los distintos componentes de una emisión lumínica en función de su longitud de onda (o frecuencia), que con una configuración experimental basada esencialmente en aquella introducida por Newton en el siglo XVII, se convertiría así en unos de los instrumentos esenciales de la física moderna. | ||
| - | Utilizando este nuevo instrumento los primeros espectroscopistas, pudieron determinar que los elementos y compuestos químicos emiten tres tipos de espectro general. El ''espectro de emisión continuo'', emitido principalmente por ''sólidos o líquidos incandescentes'', que no muestran ningún tipo de linea o raya brillante u oscura cuando la luz emitida por los mismos es observada en los espectroscopios de más alto poder de resolución. Si por otra parte aparecen rayas oscuras en un espectro de emisión continuo tenemos entonces un ''espectro de absorción'', denominando a esas | + | Utilizando este nuevo instrumento los primeros espectroscopistas, pudieron determinar que los elementos y compuestos químicos emiten tres tipos de espectro general. El '''espectro de emisión continuo''', emitido principalmente por ''sólidos o líquidos incandescentes'', que no muestran ningún tipo de linea o raya brillante u oscura cuando la luz emitida por los mismos es observada en los espectroscopios de más alto poder de resolución. Si por otra parte aparecen rayas oscuras en un espectro de emisión continuo tenemos entonces un '''espectro de absorción''', denominando a esas '''rayas o lineas de absorción'''. Por otra parte los '''espectros de emisión bandas''', que consisten en grupos de líneas brillantes que parecen ser continuas en espectroscopias de bajo poder de resolución. Este tipo de espectro es emitido cuando pequeñas piezas de material de un compuestoson calentados en una llama o con un electrodo. Por último, los '''espectros de emisión de lineas''' que se originan en la luz emitida por fuentes que contienen únicamente elementos químicos puros (e.g. un gas luminoso rarificado ''excitado'' en un [[tubo de descarga]]). Así, las rayas y bandas observados en estos resultan ser características de los elementos químicos individuales y de los compuestos químicos respectivamente cuando son excitados en determinadas condiciones. De hecho, los espectros de cada elemento o compuesto son como una “huella dactilar” que identifica a los mismos, son por ello llamados espectros característicos. |
La existencia de los espectros de emisión lineas y bandas fue un resultado experimental que la física clásica no podía explicar, esta era solo capaz de explicar los espectros de emisión continuos (aunque no su forma detallada como ocurrió al estudiar la radiación de cuerpo negro [[http://portales.educared.net/wikiEducared/index.php?title=Radiaci%C3%B3n_del_Cuerpo_Negro._Hip%C3%B3tesis_de_Planck]], pero no podía explicar la existencia y el origen de esas rayas discretas. Explicar el espectro de emisión de líneas del elemento más simple, el hidrógeno se convertiría en el trabajo de los físicos durante el primer cuarto de siglo XX, y necesito de los trabajos de Planck, Einstein y Bohr, y para la explicación de las líneas y bandas más finas del espectro se requirió finalmente del desarrollo de la teoría cuántica. | La existencia de los espectros de emisión lineas y bandas fue un resultado experimental que la física clásica no podía explicar, esta era solo capaz de explicar los espectros de emisión continuos (aunque no su forma detallada como ocurrió al estudiar la radiación de cuerpo negro [[http://portales.educared.net/wikiEducared/index.php?title=Radiaci%C3%B3n_del_Cuerpo_Negro._Hip%C3%B3tesis_de_Planck]], pero no podía explicar la existencia y el origen de esas rayas discretas. Explicar el espectro de emisión de líneas del elemento más simple, el hidrógeno se convertiría en el trabajo de los físicos durante el primer cuarto de siglo XX, y necesito de los trabajos de Planck, Einstein y Bohr, y para la explicación de las líneas y bandas más finas del espectro se requirió finalmente del desarrollo de la teoría cuántica. | ||
| + | |||
| + | Un espectro atómico es la radiación característica emitida por los átomos de un elemento individual en una llama o en un gas excitado por una descarga eléctrica. Cuando esa radiación es observada a través de un espectroscopio, la radiación aparece como un conjunto de líneas estrechas o rayas discretas cada una de un color particular o longitud de onda. Las posiciones e intensidades de cada una de las rayas son características de cada elemento. La longitud de onda de estas líneas se puede determinar con gran precisión. El primer avance significativo en la compresión de estas rayas, se produjo en 1885 cuando un profesor de matemáticas de escuela suizo llamado Johann J. Balmer (1825-1898) encontró que las rayas en la región del espectro visible del espectro de hidrógeno , el cual contiene cuatro rayas una roja, otra azul y dos violeta, con una longitud de onda de 656 nm 486 nm 410 nm y 434 nm respectivamente producido por el análisis espectroscópico de la luz emitido por átomos de hidrógeno , conocidas por ello ahora como ''serie Balmer'' podrían ser representadas y obtenidas por aplicación de la fórmula empírica: | ||
| + | |||
| + | <math>\lambda(m)=364.6\frac{m^2}{m^2-4} </math> <math>[1]</math> | ||
| + | |||
| + | con la la longitud de onda <math>\lambda(m)</math> dada en nanómetros <math>nm</math> | ||
| + | |||
| + | donde <math>m</math>m es un número entero, el cual puede tomar los valores <math>m=3,4,5...</math>. Por ejemplo para ver como la fórmula de Balmer ''funciona'', se la la longitud de onda de la línea roja llamada <math>H\alpha=656.3 nm </math> del espectro del hidrógeno, si entonces introducimos <math>m=3</math> en la fórmula de Balmer <math>[1]</math> tenemos que la misma nos dá la longitud de onda <math>\lambda</math> de esta raya <math>H\alpha</math>. La formula como se puede comprobar dá cada una de las longitudes de onda menores a medida que <math>m</math> aumenta hasta <math>6</math>. | ||
| + | |||
| + | El propio Balmer en vida pudo comprobar con gran satisfacción que una predicción realizada usando esta formula, predijo el valor de la longitud para cuando <math>m = 7 </math> se confirmó experimentalmente (con ello cumplió el sueño más preciado de todo teórico, la confirmación experimental de sus predicciones teóricas) por Ångström había observado una línea con una longitud de onda de <math>4968.1Angstrom= 496.81nm</math> Además, otros dos colegas de la ciudad en la que residia Balmer H. W. Vogel y Huggins fueron capaces de confirmar la existencia de otras líneas de la serie de Balmer a partir del espectro de hidrógeno observado al analizar la luz de estrellas blancas, todo un logro. | ||
| + | |||
| + | [[Categoría: Química]] | ||
Revisión de 12:18 28 nov 2008
Antecedentes históricos: Espectroscopia
El hombre ha tenido a lo largo de su historia contacto con uno de los fenómenos naturales más bellos que se manifiesta en un día de Sol, pero con un algunas nubes que descargan lluvia, un maravilloso “arco iris” se puede visualizar en el cielo en el lado opuesto de Sol. Aunque debería estar claro que el fenómeno estaba ligado a la presencia conjunta de luz y agua, no se comenzó a tener una idea científica clara del fenómeno hasta que en el año 1666 el gran científico Isaac Newton (1643-1726) pudo “descomponer” con un prisma de vidrio la luz blanca del Sol en los “siete” colores carasterístico de su “alma” o espectro y recomponer de nuevo el rayo de luz blanca a partir de sus colores con un segundo prisma. Newton había descubierto la dispersión de la luz por la materia, un aspecto que resultó esencial para la comprensión de la naturaleza física de la luz. Este experimento está descrito en su tratado de Óptica (Opticks en latín) publicado en 1704.
Hubo que esperar ciento cincuenta años hasta que en 1814, el físico alemán Joseph Von Fraunhofer (1787-1826) observara unas lineas o rayas oscuras (más de 600) en el espectro de la luz solar, [una observación anterior de lineas oscuras en 1802, fue realizada por el físico y químico británico William Wollaston (1766-1828)] que fueron interpretadas en 1859 por los también físicos alemanes Robert-Wilhelm Busen (1811-1899) y Gustav-Robert Kirchhoff (1824-1887) como absorciones de la luz por los átomos (en este particular caso por los gases situados en la atmósfera solar).
Poco después un número de científicos observaron rayas brillantes muy estrechas y bien definidas en el espectro de la luz emitidas por llamas, arcos voltaicos y chispas. Había nacido la espectroscopia, el espectroscopio, el aparato que sirve para separar (analizar) los distintos componentes de una emisión lumínica en función de su longitud de onda (o frecuencia), que con una configuración experimental basada esencialmente en aquella introducida por Newton en el siglo XVII, se convertiría así en unos de los instrumentos esenciales de la física moderna.
Utilizando este nuevo instrumento los primeros espectroscopistas, pudieron determinar que los elementos y compuestos químicos emiten tres tipos de espectro general. El espectro de emisión continuo, emitido principalmente por sólidos o líquidos incandescentes, que no muestran ningún tipo de linea o raya brillante u oscura cuando la luz emitida por los mismos es observada en los espectroscopios de más alto poder de resolución. Si por otra parte aparecen rayas oscuras en un espectro de emisión continuo tenemos entonces un espectro de absorción, denominando a esas rayas o lineas de absorción. Por otra parte los espectros de emisión bandas, que consisten en grupos de líneas brillantes que parecen ser continuas en espectroscopias de bajo poder de resolución. Este tipo de espectro es emitido cuando pequeñas piezas de material de un compuestoson calentados en una llama o con un electrodo. Por último, los espectros de emisión de lineas que se originan en la luz emitida por fuentes que contienen únicamente elementos químicos puros (e.g. un gas luminoso rarificado excitado en un tubo de descarga). Así, las rayas y bandas observados en estos resultan ser características de los elementos químicos individuales y de los compuestos químicos respectivamente cuando son excitados en determinadas condiciones. De hecho, los espectros de cada elemento o compuesto son como una “huella dactilar” que identifica a los mismos, son por ello llamados espectros característicos.
La existencia de los espectros de emisión lineas y bandas fue un resultado experimental que la física clásica no podía explicar, esta era solo capaz de explicar los espectros de emisión continuos (aunque no su forma detallada como ocurrió al estudiar la radiación de cuerpo negro [[1]], pero no podía explicar la existencia y el origen de esas rayas discretas. Explicar el espectro de emisión de líneas del elemento más simple, el hidrógeno se convertiría en el trabajo de los físicos durante el primer cuarto de siglo XX, y necesito de los trabajos de Planck, Einstein y Bohr, y para la explicación de las líneas y bandas más finas del espectro se requirió finalmente del desarrollo de la teoría cuántica.
Un espectro atómico es la radiación característica emitida por los átomos de un elemento individual en una llama o en un gas excitado por una descarga eléctrica. Cuando esa radiación es observada a través de un espectroscopio, la radiación aparece como un conjunto de líneas estrechas o rayas discretas cada una de un color particular o longitud de onda. Las posiciones e intensidades de cada una de las rayas son características de cada elemento. La longitud de onda de estas líneas se puede determinar con gran precisión. El primer avance significativo en la compresión de estas rayas, se produjo en 1885 cuando un profesor de matemáticas de escuela suizo llamado Johann J. Balmer (1825-1898) encontró que las rayas en la región del espectro visible del espectro de hidrógeno , el cual contiene cuatro rayas una roja, otra azul y dos violeta, con una longitud de onda de 656 nm 486 nm 410 nm y 434 nm respectivamente producido por el análisis espectroscópico de la luz emitido por átomos de hidrógeno , conocidas por ello ahora como serie Balmer podrían ser representadas y obtenidas por aplicación de la fórmula empírica:
[Unparseable or potentially dangerous latex formula. Error 3 ]![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png)
con la la longitud de onda [Unparseable or potentially dangerous latex formula. Error 3 ] dada en nanómetros 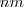
donde 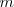 m es un número entero, el cual puede tomar los valores
m es un número entero, el cual puede tomar los valores 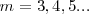 . Por ejemplo para ver como la fórmula de Balmer funciona, se la la longitud de onda de la línea roja llamada
. Por ejemplo para ver como la fórmula de Balmer funciona, se la la longitud de onda de la línea roja llamada 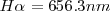 del espectro del hidrógeno, si entonces introducimos
del espectro del hidrógeno, si entonces introducimos 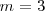 en la fórmula de Balmer
en la fórmula de Balmer ![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png) tenemos que la misma nos dá la longitud de onda
tenemos que la misma nos dá la longitud de onda 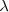 de esta raya
de esta raya 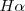 . La formula como se puede comprobar dá cada una de las longitudes de onda menores a medida que
. La formula como se puede comprobar dá cada una de las longitudes de onda menores a medida que 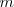 aumenta hasta
aumenta hasta 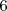 .
.
El propio Balmer en vida pudo comprobar con gran satisfacción que una predicción realizada usando esta formula, predijo el valor de la longitud para cuando 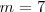 se confirmó experimentalmente (con ello cumplió el sueño más preciado de todo teórico, la confirmación experimental de sus predicciones teóricas) por Ångström había observado una línea con una longitud de onda de
se confirmó experimentalmente (con ello cumplió el sueño más preciado de todo teórico, la confirmación experimental de sus predicciones teóricas) por Ångström había observado una línea con una longitud de onda de 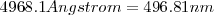 Además, otros dos colegas de la ciudad en la que residia Balmer H. W. Vogel y Huggins fueron capaces de confirmar la existencia de otras líneas de la serie de Balmer a partir del espectro de hidrógeno observado al analizar la luz de estrellas blancas, todo un logro.
Además, otros dos colegas de la ciudad en la que residia Balmer H. W. Vogel y Huggins fueron capaces de confirmar la existencia de otras líneas de la serie de Balmer a partir del espectro de hidrógeno observado al analizar la luz de estrellas blancas, todo un logro.



