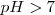Equilibrio en las disoluciones acuosas de las sales. Hidrólisis de las sales de ácido o base débiles
De Wikillerato
(Página nueva: ==Hidrólisis de las sales de ácido o base débiles== Cuando un ácido neutraliza una base, el componente iónico formado se llama sal. Las sales en solución pueden ser neutras, á...) |
(Página nueva: ==Hidrólisis de las sales de ácido o base débiles== Cuando un ácido neutraliza una base, el componente iónico formado se llama sal. Las sales en solución pueden ser neutras, á...) |
Revisión actual
Tabla de contenidos |
Hidrólisis de las sales de ácido o base débiles
Cuando un ácido neutraliza una base, el componente iónico formado se llama sal. Las sales en solución pueden ser neutras, ácidas o básicas, dependiendo de las propiedades ácido-base de los cationes y aniones constituyentes de las bases. Como regla general, las sales formadas por reacción de un ácido fuerte y una base fuerte son neutras, las sales formadas por reacción de un ácido fuerte y base débil son ácidas y las sales formadas por reacción de un ácido débil con una base fuerte son básicas:
Ácido fuerte + Base fuerte --> Solución neutra Ácido fuerte + Base débil --> Solución Ácida Ácido débil + Base fuerte --> Solución Básica
La propiedad de las sales de producir disoluciones ácido o básico al disolverse en agua, se conoce tradicionalmente como hidrólisis (del griego hidro, agua y lisis, ruptura). Aunque en realidad la hidrólisis no es un fenómeno diferente al de la disociación de ácidos y bases débiles. Estos la hidrólisis es simplemente la interacción ácido-base de los iones componentes de la sal con las moléculas de agua que les rodean en disolución. Por ello el término hidrólisis con el que se describe este fenómeno está cada vez más en desuso pues no se trata de un fenómeno distinto del resto de las disociaciones o ionizaciones ácido-base.
La base conjugada de un ácido débil tiene tendencia a captar un protón y generar el ácido débil, y está reacción tendrá lugar con tanta más intensidad cuanto más débil sea el ácido. Análogamente el ácido conjugado de una base débil tendrá tendencia a ceder un protón para regenerar la base, y lo hará con tanta más fuerza cuanta más débil sea la base.
Puesto que la sal resulta de la neutralización reciproca de un ácido y una base, estará constituida por un anión, base conjugada del ácido, y un catión, ácido conjugado de la base. Si el anión procede de ácido débil, o el catión procede de base débil, habrá transferencia de protones con el agua circundante, lo que conllevará una alteración del pH
Existen cuatro tipos de hidrólisis de sales
Sales de ácido y base fuerte
Consideremos la reacción de neutralización del ácido clorhídrico (ácido fuerte) con soluciones acuosas de hidróxido de sodio para dar agua y una solución acuosa de cloruro sódico:

Debido a que el 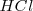 ,
, 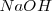 , y el
, y el 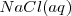 están completamente disociados, la reacción neta de neutralización es:
están completamente disociados, la reacción neta de neutralización es:
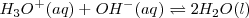
Si se mezclan igual número de moles de 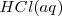 y
y 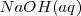 , las concentraciones de los iones hidronios
, las concentraciones de los iones hidronios 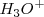 e iones hidróxido
e iones hidróxido 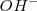 que permanecen en la disolución después de la de neutralización será la misma que la del agua pura,
que permanecen en la disolución después de la de neutralización será la misma que la del agua pura, ![[H_3O^+]=[OH^-]= 1.0 x 10^-7 M [H_3O^+]=[OH^-]= 1.0 x 10^-7 M](/images/math/math-86c084f97dea6ed0cffdc436b650d8c7.png) . En otras palabras la reacción del
. En otras palabras la reacción del 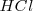 con el
con el 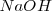 procede hacia la derecha en la ecuación de neutralización para realizarse de forma completa.
procede hacia la derecha en la ecuación de neutralización para realizarse de forma completa.
Debido a que la reacción de neutralización de un ácido fuerte con una base fuerte es la reversa de la disociación del agua su constante de equilibrio 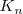 (n de neutralización), es la reciproca del producto iónico del agua (
(n de neutralización), es la reciproca del producto iónico del agua (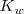 9:
9:
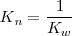
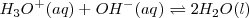
![K_n = \frac {1} {[H_3O^+] [OH^-]} = 1.0 x 10^{14} K_n = \frac {1} {[H_3O^+] [OH^-]} = 1.0 x 10^{14}](/images/math/math-bd5ff5c0cc81b85b7b4b204009fdf3d2.png)
Este valor de 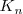 indica que para un ácido fuerte y una base fuerte la reacción de neutralización procede esencialmente hasta alcanzar el
indica que para un ácido fuerte y una base fuerte la reacción de neutralización procede esencialmente hasta alcanzar el 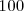 . Puesto que ninguno de los componentes de la sal (anión ni catión) reacciona con el agua para producir iones hidronios
. Puesto que ninguno de los componentes de la sal (anión ni catión) reacciona con el agua para producir iones hidronios 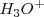 o iones hidróxido^
o iones hidróxido^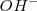 , la disolución resultante será neutra, esto es el
, la disolución resultante será neutra, esto es el 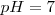 . No hay hidrólisis
. No hay hidrólisis
Sales de ácido débil y base fuerte
Debido a que un ácido débil 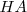 está en gran parte sin disociar, la ecuación neta iónica para la reacción neutralización involucra la tranferenia de un protón desde el ácido
está en gran parte sin disociar, la ecuación neta iónica para la reacción neutralización involucra la tranferenia de un protón desde el ácido 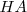 a la base fuerte
a la base fuerte 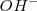 :
:
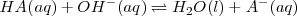
Ejemplo:
El ácido acético 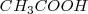 , reacciona con hidroxido de sodio (
, reacciona con hidroxido de sodio (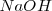 ) en solución acuosa para dar agua y acetato de sodio acuoso (CH_3COONa):
) en solución acuosa para dar agua y acetato de sodio acuoso (CH_3COONa):
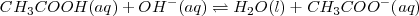
Lo iones 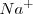 no aparecen en la ecuación iónica neta debido a que ambos el
no aparecen en la ecuación iónica neta debido a que ambos el 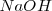 y el
y el 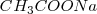 se encuentran totalmente disociados en la disolución.
se encuentran totalmente disociados en la disolución.
Después de la neutralización de igual cantidades molares de ácido acético y de hidróxido de sodio, la solución contiene iones 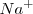 que no reaccionan con el agua (no tiene propiedades ácida o básica) e iones acetato
que no reaccionan con el agua (no tiene propiedades ácida o básica) e iones acetato 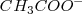 que es una base débil (es la base conjugada de un ácido débil) por lo que actua como tal y capta un protón de una molécula de agua. La consiguiente producción de ion hidróxido da por resultado una disolución básica. Esto es con un
que es una base débil (es la base conjugada de un ácido débil) por lo que actua como tal y capta un protón de una molécula de agua. La consiguiente producción de ion hidróxido da por resultado una disolución básica. Esto es con un 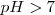 .
.
Sales de ácido fuerte y base débil
Un ácido fuerte 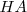 está completadamente disociado en
está completadamente disociado en 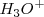 e iones
e iones 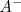 , y la reacción de neutralización por lo tanto involucra la transferencia protónica desde
, y la reacción de neutralización por lo tanto involucra la transferencia protónica desde 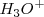 a la base débil B:
a la base débil B:
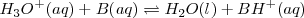
Por ejemplo, la ecuación iónica neta para la neutralización del ácido clorhídrico 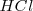 con una solución acuosa de amoniaco <NH_3 </math> es:
con una solución acuosa de amoniaco <NH_3 </math> es:
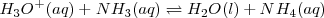
Se puede obtener la constante de equilibrio para esta reacción de neutralización multiplicando las constantes de equilibrio conocidas para las reacciones que añadidas dan la reacción neta iónica:
<NH_3 (aq) + H_2O (l) \rightleftharpoons NH_4^+ (aq) + OH^- (aq) </math> 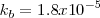
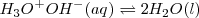
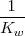
Neta: 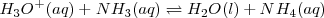
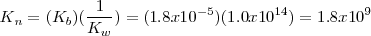
La reacción de neutralización procede casi al 100 % debido a que la constante de equilibrio para la neutralización es un número muy grande. Así, la neutralización de cualquier base débil con un ácido fuerte generalmente se realiza al 100 % de completitud debido a que el 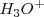 es un poderoso donador de protones. Después de la neutralización de cantidades molares idiguales de amoniaco
es un poderoso donador de protones. Después de la neutralización de cantidades molares idiguales de amoniaco 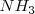 y ácido clorhídrico
y ácido clorhídrico 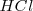 , la solución contiene iones
, la solución contiene iones 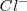 que no tienen ni propiedades ácidas ni básicas e iones amonio
que no tienen ni propiedades ácidas ni básicas e iones amonio 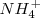 , el cual es un ácido débil por lo que tiende a regenerar el amoniaco cediendo un protón a la molécula de agua. El ión hidronio formado dará carácter ácido a la disolución. i.e.
, el cual es un ácido débil por lo que tiende a regenerar el amoniaco cediendo un protón a la molécula de agua. El ión hidronio formado dará carácter ácido a la disolución. i.e. 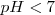
Sales de ácido y base débiles
Tanto un ácido débil 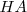 como una base débil
como una base débil 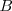 están en su mayor parte disociar, y la reacción de neutralización por lo tanto involucra la transferencia protónica desde el ácido débil a la base débil. Por ejemplo la ecuación iónica neta para la neutralización del ácido acético con amoniaco acuoso es:
están en su mayor parte disociar, y la reacción de neutralización por lo tanto involucra la transferencia protónica desde el ácido débil a la base débil. Por ejemplo la ecuación iónica neta para la neutralización del ácido acético con amoniaco acuoso es:
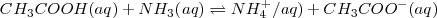
En este caso la constante de equilibrio 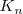 puede ser obtenida anadiendo las ecuaciones 1) la disociación del ácido acético 2) la protonación de la base 3) la disociación reversa del agua:
puede ser obtenida anadiendo las ecuaciones 1) la disociación del ácido acético 2) la protonación de la base 3) la disociación reversa del agua:
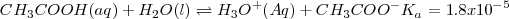
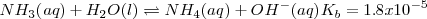
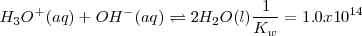
Reacción neta:
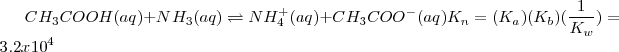
El valor de 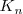 indica que la neutralización se encuentra lejos de la completitud. Así, en general en las reacciones neutralización de un ácido débil con una base débil tiene menos tendencia a proceder hasta la completitud que las neutralizaciones que involucran ácidos o bases fuertes. El carácter ácido o básico de la disolución después de la neutralización dependerá de las constantes de disociación del ácido y de la base que generaron la sal.
indica que la neutralización se encuentra lejos de la completitud. Así, en general en las reacciones neutralización de un ácido débil con una base débil tiene menos tendencia a proceder hasta la completitud que las neutralizaciones que involucran ácidos o bases fuertes. El carácter ácido o básico de la disolución después de la neutralización dependerá de las constantes de disociación del ácido y de la base que generaron la sal.
Por ejemplo en la neutralización del ácido cianhídrico 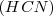 (ácido débil) con amoniaco (base débil)
(ácido débil) con amoniaco (base débil) 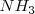 la constante de acidez
la constante de acidez 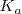 del ácido cianhídrico vale
del ácido cianhídrico vale 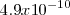 , mientras que la constante de basicidad
, mientras que la constante de basicidad 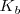 del amoniaco es
del amoniaco es 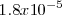 . Al ser el cianhídrico más débil como ácido que el amoniaco como base, la base conjugada de cianuro será más fuerte como base que el amonio como ácido conjugado. En consecuencia, la reacción del cianuro con el agua será más intensa que la del amonio, y por ello la disolución será básica i.e. tendrá un
. Al ser el cianhídrico más débil como ácido que el amoniaco como base, la base conjugada de cianuro será más fuerte como base que el amonio como ácido conjugado. En consecuencia, la reacción del cianuro con el agua será más intensa que la del amonio, y por ello la disolución será básica i.e. tendrá un