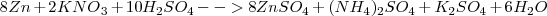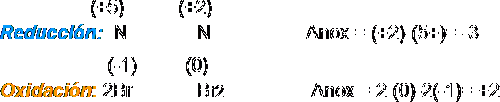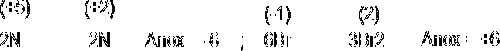Reacciones de oxidación-reducción. Ajuste estequiométrico
De Wikillerato
m (Revertidas las ediciones realizadas por 88.11.66.128 (Talk); a la última edición de Chemaseg) |
|||
| Línea 2: | Línea 2: | ||
===Introducción=== | ===Introducción=== | ||
| - | + | ||
| + | ''Ajustar'' una reacción química significa poner los coeficientes numéricos que sean necesarios a las sustancias que intervienen en la misma para que se cumpla el principio de conservación de los átomos de cada elemento al efectuarse la reacción. | ||
| + | |||
| + | En las reacciones sencillas este ajuste puede hacerse por tanteo sin mayores dificultades. Pero a medida que las reacciones son más complicadas el método del tanteo se vuelve complicado. Por ello es necesario disponer de un método que permita realizar esta operación de ajuste de un modo fácil y sistemático. | ||
| + | |||
| + | Para ajustar '''reacciones de óxidación-reducción''' (''redox'') se tiene como fundamento el [[principio de la conservación de la carga eléctrica]]. Esto es, en una reacción redox de transferencia de los electrones se tiene que: | ||
| + | {{teorema|1=Los electrones que pierde total o parcialmente un reductor tienen que ser los mismos que adquiere el oxidante.|2=[[Principio de la conservación de la carga eléctrica]]}} | ||
| + | |||
| + | Hay dos métodos de ajustes de las reacciones redox: el del [[número de oxidación]], y el de ''ión-electrón''. El primero es útil porque se centra en los cambios químicos involucrados, mientras que el de ión-electrón es útil porque se focaliza en la transferencia de electrones. | ||
| + | |||
| + | Antes de proceder al ajuste de una reacción redox se debe disponer de una reacción escrita en forma cualitativa y completa,con todos sus reaccionantes y productos. | ||
| + | |||
| + | ===Método del número de oxidación=== | ||
| + | |||
| + | Es el método más conveniente a emplear para reacciones redox entre sustancias moleculares, covalentes como las que suelen darse en fase gaseosa. | ||
| + | |||
| + | La clave del método del número de oxidación (nox) para el ajuste (también llamado balanceo) es tener en cuanta que el cambio en el total de todos los números de oxidación debe ser cero. Esto es, que los incrementos del nox del oxidante y del reductor deben anularse entre si al sumar los algebraicamente para de este modo cumplir con el principio de conservación de la carga eléctrica. Esto es un incremento en el número de oxidación para el átomo oxidado debe compensarse con una disminución en el nox del átomo reducido. | ||
| + | |||
| + | Los pasos a dar para ajustar una reacción redox con este método son los siguientes: | ||
| + | |||
| + | '''1.-''' Se escribe la ecuación de la reacción redox a ajustar. Se ajusta la ecuación para todos los átomos que interviene en la misma utilizando los coeficientes estequiométricos apropiados. | ||
| + | |||
| + | '''2.''' Se escribe encima del símbolo de cada elemento su número de oxidación, y se identifica los elementos que han cambiado su nox i.e. el oxidante y al reductor en la reacción . | ||
| + | |||
| + | '''3.-''' Hay que encontrar el neto incremento de nox de los átomos que sufren oxidación y el descenso neto del número de oxidación de los elementos que se han reducido. Así, para el oxidante se extrae su símbolo y se escribe su nox en sus dos estados, como reaccionate y como producto. Lo mismo se hace tonel reductor. | ||
| + | |||
| + | '''4.-''' Se multiplican ambos incrementos por los números convenientes para igualar el valor absoluto de sus cargas (que será el mínimo común múltiplo a ambos incrementos) de tal manera que ambos incrementos sean iguales. A continuación , oxidante y reductor intercambian sus multiplicadores y se comprueba que quedan ajustadas sus variaciones de carga en la reacción. | ||
| + | |||
| + | '''5.-''' Los multiplicadores se introducen ahora como coeficientes. Teniendo en cuenta que lo importante es el número de átomos del elemento considerado, y que por lo tanto, los coeficientes pueden ser suplidos por subíndices, cuando los hay en la formula correspondiente. | ||
| + | |||
| + | '''6.-''' Finalmente, se ajusta el coeficiente de aquellas sustancias cuyo elementos no han participado en el proceso redox pero si en la reacción global. El agua suele serla molécula más frecuente en ser ajustada | ||
| + | |||
| + | Ejemplo de aplicación de estas reglas: | ||
| + | |||
| + | El ácido nítrico <math>HNO_3 </math> reacciona con el ácido bromhídrico <math> HBr </math> para dar bromo libre (<math>B_2 </math>, monóxido de nitrógeno <math>NO </math> y agua <math>H_2O </math>. | ||
| + | |||
| + | El ajuste de esta reacción redox se realizaría de la siguiente manera siguiendo los pasos del método del número de oxidación. | ||
| + | |||
| + | Se escribe en primer lugar la ecuación de la reacción en forma solo cualitativa (sin ajustar): | ||
| + | |||
| + | <math> HNO_3 + HBr --> Br_2 + NO+ H_2O </math> | ||
| + | |||
| + | 1. Se anotan los nox de cada elemento (incluidos entre paréntesis) y se identifica a continuación el elemento oxidante (que sufre una reducción) y el reductor (que sufre oxidación). | ||
| + | |||
| + | [[Imagen:Redox_A.gif]] | ||
| + | |||
| + | 2 y 3. Se extraen por separado los procesos atómicos de oxidación y reducción: | ||
| + | |||
| + | [[Imagen:Redox_B.gif|500px]] | ||
| + | |||
| + | 3. Se igualan los incrementos multiplicando la reducción por 2 y la oxidación por 3: | ||
| + | |||
| + | [[Imagen:Redox_C.gif|500px]] | ||
| + | |||
| + | 4.- Los coeficientes atómicos moleculares obtenidos enel paso anterior se introducen como coeficientes en la reacción: | ||
| + | |||
| + | <math> 2HNO_3 + 6HBr --> 3Br_2 + 2NO+ H_2O </math> | ||
| + | |||
| + | 5. Finalmente hay que ajustar el número de moléculas de agua que stan sin ajustar. El coeficiente estequiométrico del agua <math>H_2O</math> viene determinado por el contenido de H y O de los reactivos ya ajustados: | ||
| + | |||
| + | Esto es: | ||
| + | |||
| + | <math> 2HNO_3 + 6HBr --> Br_2 + 2NO + 4H_2O </math> Reacción redox ajustada | ||
| + | |||
| + | El ajuste se ha terminado, pero hay que tener el hábito de comprobar que este se ha ealizado de manera correcta contando los los átomos de cada elemento en las sustancias reaccionantes y en los productos de la reacción. | ||
| + | |||
| + | ===Método del ión-electrón=== | ||
| + | |||
| + | Para las [[reacciones redox]] en disolución, este método es el más usado ya que trata con cantidades reales como son los iones presentes en el medio acuoso. | ||
| + | |||
| + | Como en el [[método del número de oxidación]], primero hay que localizar al oxidante y al reductor. Pero en este caso se desglosan dos semireacciones, una de oxidación y otra de reducción, en las que se representan los iones o moléculas que son o contienen a los protagonistas redox. | ||
| + | |||
| + | Esta metodología de ajuste de las reacciones redox sigue los siguientes pasos: | ||
| + | |||
| + | '''1.-''' Se escriben las dos semireacciones en forma cualitativa, donde se detallan las especies químicas afectadas por el proceso redox. | ||
| + | |||
| + | '''2.-''' Se procede entonces al ''ajuste atómico'' de cada semireacción, teniendo en cuenta que si el medio es: | ||
| + | |||
| + | .- ''Ácido'', en cuyo caso, si hay exceso de oxígeno en un reacciónate respecto de du producto se añade iones <math> H^+ </math>, que combinándose con el exceso de oxígeno, formarán agua en el segundo miembro de la reacción. Por otra parte si hay defecto de oxigeno, se añadirá <math>H_2O </math> al primer miembro como fuente de oxígeno, y los hidrógenos del agua aparecerán en el segundo miembro como protones <math>H^+ </math> | ||
| + | |||
| + | .- ''Básico'', en cuyo caso el exceso de oxígeno en el reaccionante es absorbido añadiendo agua al primer miembro, que pasa al segundo miembro como iones <math> OH^- </math> . Si hay defecto de oxígeno en algún reaccionante, se añade al primer miembreo iones <math>OH^- </math>, que proporcionarán el oxígeno necesario y se transformará en agua, que aparecerá en el segundo miembro. | ||
'''3.-''' Se ajustan los átomos de cada semireacción, se procede al ajuste eléctrico añadiendo los electrones que corresponda en el miembro pertinente de cada semireacción. | '''3.-''' Se ajustan los átomos de cada semireacción, se procede al ajuste eléctrico añadiendo los electrones que corresponda en el miembro pertinente de cada semireacción. | ||
Revisión actual
Tabla de contenidos |
Ajuste estequiométrico de reacciones redox
Introducción
Ajustar una reacción química significa poner los coeficientes numéricos que sean necesarios a las sustancias que intervienen en la misma para que se cumpla el principio de conservación de los átomos de cada elemento al efectuarse la reacción.
En las reacciones sencillas este ajuste puede hacerse por tanteo sin mayores dificultades. Pero a medida que las reacciones son más complicadas el método del tanteo se vuelve complicado. Por ello es necesario disponer de un método que permita realizar esta operación de ajuste de un modo fácil y sistemático.
Para ajustar reacciones de óxidación-reducción (redox) se tiene como fundamento el principio de la conservación de la carga eléctrica. Esto es, en una reacción redox de transferencia de los electrones se tiene que:
|
Hay dos métodos de ajustes de las reacciones redox: el del número de oxidación, y el de ión-electrón. El primero es útil porque se centra en los cambios químicos involucrados, mientras que el de ión-electrón es útil porque se focaliza en la transferencia de electrones.
Antes de proceder al ajuste de una reacción redox se debe disponer de una reacción escrita en forma cualitativa y completa,con todos sus reaccionantes y productos.
Método del número de oxidación
Es el método más conveniente a emplear para reacciones redox entre sustancias moleculares, covalentes como las que suelen darse en fase gaseosa.
La clave del método del número de oxidación (nox) para el ajuste (también llamado balanceo) es tener en cuanta que el cambio en el total de todos los números de oxidación debe ser cero. Esto es, que los incrementos del nox del oxidante y del reductor deben anularse entre si al sumar los algebraicamente para de este modo cumplir con el principio de conservación de la carga eléctrica. Esto es un incremento en el número de oxidación para el átomo oxidado debe compensarse con una disminución en el nox del átomo reducido.
Los pasos a dar para ajustar una reacción redox con este método son los siguientes:
1.- Se escribe la ecuación de la reacción redox a ajustar. Se ajusta la ecuación para todos los átomos que interviene en la misma utilizando los coeficientes estequiométricos apropiados.
2. Se escribe encima del símbolo de cada elemento su número de oxidación, y se identifica los elementos que han cambiado su nox i.e. el oxidante y al reductor en la reacción .
3.- Hay que encontrar el neto incremento de nox de los átomos que sufren oxidación y el descenso neto del número de oxidación de los elementos que se han reducido. Así, para el oxidante se extrae su símbolo y se escribe su nox en sus dos estados, como reaccionate y como producto. Lo mismo se hace tonel reductor.
4.- Se multiplican ambos incrementos por los números convenientes para igualar el valor absoluto de sus cargas (que será el mínimo común múltiplo a ambos incrementos) de tal manera que ambos incrementos sean iguales. A continuación , oxidante y reductor intercambian sus multiplicadores y se comprueba que quedan ajustadas sus variaciones de carga en la reacción.
5.- Los multiplicadores se introducen ahora como coeficientes. Teniendo en cuenta que lo importante es el número de átomos del elemento considerado, y que por lo tanto, los coeficientes pueden ser suplidos por subíndices, cuando los hay en la formula correspondiente.
6.- Finalmente, se ajusta el coeficiente de aquellas sustancias cuyo elementos no han participado en el proceso redox pero si en la reacción global. El agua suele serla molécula más frecuente en ser ajustada
Ejemplo de aplicación de estas reglas:
El ácido nítrico 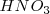 reacciona con el ácido bromhídrico
reacciona con el ácido bromhídrico 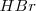 para dar bromo libre (
para dar bromo libre (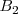 , monóxido de nitrógeno
, monóxido de nitrógeno 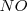 y agua
y agua 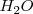 .
.
El ajuste de esta reacción redox se realizaría de la siguiente manera siguiendo los pasos del método del número de oxidación.
Se escribe en primer lugar la ecuación de la reacción en forma solo cualitativa (sin ajustar):
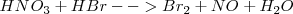
1. Se anotan los nox de cada elemento (incluidos entre paréntesis) y se identifica a continuación el elemento oxidante (que sufre una reducción) y el reductor (que sufre oxidación).
2 y 3. Se extraen por separado los procesos atómicos de oxidación y reducción:
3. Se igualan los incrementos multiplicando la reducción por 2 y la oxidación por 3:
4.- Los coeficientes atómicos moleculares obtenidos enel paso anterior se introducen como coeficientes en la reacción:

5. Finalmente hay que ajustar el número de moléculas de agua que stan sin ajustar. El coeficiente estequiométrico del agua 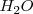 viene determinado por el contenido de H y O de los reactivos ya ajustados:
viene determinado por el contenido de H y O de los reactivos ya ajustados:
Esto es:
Reacción redox ajustada
El ajuste se ha terminado, pero hay que tener el hábito de comprobar que este se ha ealizado de manera correcta contando los los átomos de cada elemento en las sustancias reaccionantes y en los productos de la reacción.
Método del ión-electrón
Para las reacciones redox en disolución, este método es el más usado ya que trata con cantidades reales como son los iones presentes en el medio acuoso.
Como en el método del número de oxidación, primero hay que localizar al oxidante y al reductor. Pero en este caso se desglosan dos semireacciones, una de oxidación y otra de reducción, en las que se representan los iones o moléculas que son o contienen a los protagonistas redox.
Esta metodología de ajuste de las reacciones redox sigue los siguientes pasos:
1.- Se escriben las dos semireacciones en forma cualitativa, donde se detallan las especies químicas afectadas por el proceso redox.
2.- Se procede entonces al ajuste atómico de cada semireacción, teniendo en cuenta que si el medio es:
.- Ácido, en cuyo caso, si hay exceso de oxígeno en un reacciónate respecto de du producto se añade iones 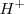 , que combinándose con el exceso de oxígeno, formarán agua en el segundo miembro de la reacción. Por otra parte si hay defecto de oxigeno, se añadirá
, que combinándose con el exceso de oxígeno, formarán agua en el segundo miembro de la reacción. Por otra parte si hay defecto de oxigeno, se añadirá 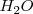 al primer miembro como fuente de oxígeno, y los hidrógenos del agua aparecerán en el segundo miembro como protones
al primer miembro como fuente de oxígeno, y los hidrógenos del agua aparecerán en el segundo miembro como protones 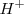
.- Básico, en cuyo caso el exceso de oxígeno en el reaccionante es absorbido añadiendo agua al primer miembro, que pasa al segundo miembro como iones 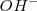 . Si hay defecto de oxígeno en algún reaccionante, se añade al primer miembreo iones
. Si hay defecto de oxígeno en algún reaccionante, se añade al primer miembreo iones 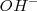 , que proporcionarán el oxígeno necesario y se transformará en agua, que aparecerá en el segundo miembro.
, que proporcionarán el oxígeno necesario y se transformará en agua, que aparecerá en el segundo miembro.
3.- Se ajustan los átomos de cada semireacción, se procede al ajuste eléctrico añadiendo los electrones que corresponda en el miembro pertinente de cada semireacción.
4.- Hay que igualar los electrones producidos en la semireacción de oxidación con los consumidos en la de reducción, por el mismo procedimiento del mínimo común múltiplo.
5.- Se suman las semireacciones, se eliminan términos comunes en ambos miembros de la reacción global, y ya se tiene la reacción ajustada.
Ejemplo:
El ión nitrato reacciona en medio ácido con el cinc metálico para dar ión amonio e ión cinc. El ajuste de esta reacción redox se realizaría por el método de ión-electrón de la siguiente manera:
1.- Las semireacciones de este proceso redox son:
Oxidación: 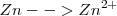 (el número de oxidación –nox- pasa de 0 a 2+)
(el número de oxidación –nox- pasa de 0 a 2+)
Reducción: 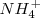 ( el nox del N pasa de +5 a -3)
( el nox del N pasa de +5 a -3)
2. Ajuste atómico: El Zn no necesita nada, ya que está ajustado. El nitrato pierde oxígeno, que al estar en medio ácido será capturado por iones 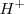 para formar moléculas de agua (
para formar moléculas de agua (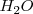 ). Por lo tanto, las semireacciones quedan atómicamente ajustadas así:
). Por lo tanto, las semireacciones quedan atómicamente ajustadas así:
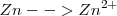

3. Se realiza el ajuste eléctrico para conservar la carga:
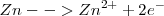
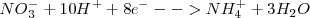
4.- Igualación de lo electrones de ambas semireacciones:
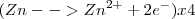
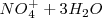
5.- Suma de semireacciones y eliminación de términos comunes (en este caso, solo los electrones):
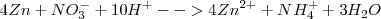
La reacción iónica que es la más importante la tenemos ya ajustada.
Para ajustar la reacción molecular en la que se expresa ya no solo los iones participantes, sino los compuestos reales que los contienen y con los que se preparan las disoluciones, se emplean los siguientes criterios:
Para pasar de la ecuación iónica a la molecular, lo iones hidrógeno pueden ser sustituidos por ácido sulfúrico (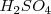 , y los iones hidróxido por hidróxido de sodio
, y los iones hidróxido por hidróxido de sodio 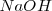 o hidroxido de potasio
o hidroxido de potasio 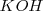 . Los cationes pueden parecer como sulfatos y los aniones como sales de sodio o potasio.
. Los cationes pueden parecer como sulfatos y los aniones como sales de sodio o potasio.
La ecuación iónica anterior se ajustaría molecularmente de la siguiente manera:
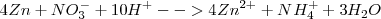
Lo diez protones 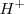 los aportan diez moléculas de ácido sulfúrico con el nitrato siendo de potasio (
los aportan diez moléculas de ácido sulfúrico con el nitrato siendo de potasio (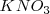 ) :
) :
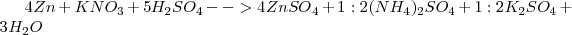
El ajuste no es incompatible con el empleo de coeficientes fraccionarios (e.g 1/2 , representado en la ecuación anterior como 1:2) , y que estos se pueden eliminar multiplicando los dos miembros de la ecuación por el mismo número natural.
Así en este caso, multiplicando por dos desaparecen los coeficientes fraccionarios:
Y la ecuación redox está ajustada iónicamente y molecularmente. Tweet