Ley de acción de masas
De Wikillerato
(→Ley de acción de masas) |
|||
| Línea 3: | Línea 3: | ||
La '''ley de acción de masas''' (LAM, llamada así debido a que en los inicios de la química científica la concentración fue denominada masa activa) es una generalización de la expresión de la constante de equilibrio <math> K_c </math> para cualquier tipo de reacciones. La expresión de esta ley fundamental fue propuesta en 1864 por los químicos noruegos Cato Maximillian Guldberg (1836-1902) y Peter Waage (1833-1900), basándose en el estudio experimental de numerosas [[reacciones reversibles]] y en los trabajos del químico francés Claude Louis Berthellot (1748-1822) sobre la cinética de las reacciones químicas. | La '''ley de acción de masas''' (LAM, llamada así debido a que en los inicios de la química científica la concentración fue denominada masa activa) es una generalización de la expresión de la constante de equilibrio <math> K_c </math> para cualquier tipo de reacciones. La expresión de esta ley fundamental fue propuesta en 1864 por los químicos noruegos Cato Maximillian Guldberg (1836-1902) y Peter Waage (1833-1900), basándose en el estudio experimental de numerosas [[reacciones reversibles]] y en los trabajos del químico francés Claude Louis Berthellot (1748-1822) sobre la cinética de las reacciones químicas. | ||
| - | Consideremos una reacción reversible general: | + | Consideremos una reacción reversible general: olaz normita k tal |
<math> aA+ bB \rightleftharpoons cC+ dD </math> | <math> aA+ bB \rightleftharpoons cC+ dD </math> | ||
Revisión de 13:44 13 nov 2012
Ley de acción de masas
La ley de acción de masas (LAM, llamada así debido a que en los inicios de la química científica la concentración fue denominada masa activa) es una generalización de la expresión de la constante de equilibrio 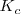 para cualquier tipo de reacciones. La expresión de esta ley fundamental fue propuesta en 1864 por los químicos noruegos Cato Maximillian Guldberg (1836-1902) y Peter Waage (1833-1900), basándose en el estudio experimental de numerosas reacciones reversibles y en los trabajos del químico francés Claude Louis Berthellot (1748-1822) sobre la cinética de las reacciones químicas.
para cualquier tipo de reacciones. La expresión de esta ley fundamental fue propuesta en 1864 por los químicos noruegos Cato Maximillian Guldberg (1836-1902) y Peter Waage (1833-1900), basándose en el estudio experimental de numerosas reacciones reversibles y en los trabajos del químico francés Claude Louis Berthellot (1748-1822) sobre la cinética de las reacciones químicas.
Consideremos una reacción reversible general: olaz normita k tal

Donde A y B son los reactivos, C y D son los productos y a y b y d son los coeficientes estequiométricos en la ecuación química balanceada.
Según ley del equilibrio químico o la ley de acción de masas o las concentraciones en una mezcla en equilibrio están relacionadas por la siguiente ecuación del equilibrio:
Para cualquier proceso químico en equilibrio, a una temperatura determinada, se cumple que el cociente entre las concentraciones molares (moles/l) de los productos y de los reactivos, elevadas a sus respectivos coeficientes estequiométricos, es una constante que depende de la temperatura, llamada constante de equilibrio denotada como: 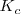 , el subindice c indica que las cantidades de los reactivos y de los productos estan expresadas como concentraciones molares.
, el subindice c indica que las cantidades de los reactivos y de los productos estan expresadas como concentraciones molares.
Así, la constante de equilibrio 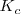 es un número obtienido al multiplicar las concentraciones molares en el equilibrio de todos los productos y dividiendo esto por el producto de las concentraciones molares en el equilibrio de todos los reactivos elevadas a la potencia de sus coeficientes estequiométricos respectivos.
es un número obtienido al multiplicar las concentraciones molares en el equilibrio de todos los productos y dividiendo esto por el producto de las concentraciones molares en el equilibrio de todos los reactivos elevadas a la potencia de sus coeficientes estequiométricos respectivos.
Con independencia de de las concentraciones individuales en el equilibrio en un particular experimento químico, la constante de equilibrio para una reacción química a una temperatura particular siempre tiene el mismo valor.
La constante de equilibrio puede simbolizarse también por 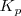 , expresa en función de las presiones (en atmósferas) de los gases, considerados ideales, que intervienen en un sistema homogéneo en estado gaseoso.
, expresa en función de las presiones (en atmósferas) de los gases, considerados ideales, que intervienen en un sistema homogéneo en estado gaseoso.
La constante de equilibrio nos indica en que sentido se desplaza la reacción. Expresa la tendencia de los reactivos a convertirse en productos y viceversa. Está relacionada con la variación de la energía de la reacción 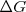 que nos indica su espontaneidad.
que nos indica su espontaneidad.


![K_c =\frac{[C]^{c} [D]^{d}}{[A]^{a} [B]^{b}} K_c =\frac{[C]^{c} [D]^{d}}{[A]^{a} [B]^{b}}](/images/math/math-471e3ce39b15a227da0de146a9c63089.png)

