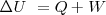Convenio de signos en las transformaciones termodinámicas
De Wikillerato
Chemaseg (Discutir | contribuciones)
(Página nueva: Criterios convencional de signos en las transformaciones Termodinámicas: El primer principio de la termodinámica se expres en terminos matemáticos en la siguiente ecuación: ...)
Ir a las siguientes diferencias →
Revisión de 09:56 1 jun 2010
Criterios convencional de signos en las transformaciones Termodinámicas:
El primer principio de la termodinámica se expres en terminos matemáticos en la siguiente ecuación:
El cambio en la energía interna 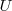 de un sistema está relacida con la energía que intercambia con su entorno, en forma de calor, y con el trabajo
de un sistema está relacida con la energía que intercambia con su entorno, en forma de calor, y con el trabajo 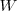 que el sistema realiza sobre los alrededores o el sistema sobre este
que el sistema realiza sobre los alrededores o el sistema sobre este
El signo  y
y  depende si al transferir energía al sistema com calor
depende si al transferir energía al sistema com calor 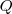 o trabajo
o trabajo 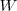 la energía interna
la energía interna 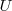 del sistema aumenta o no, así :
del sistema aumenta o no, así :
, i.e.
es positivo
, si se tranfiere calor al sistema, aumentando con ello su energía interna.
, i.e.
negativo
, si el sistema cede calor al entorno exteror, disminiyendo con ello su enería interna.
,i.e.
positivo
, si se realiza trabajo sobre el sistema, aumentando así su enegía interna.
, i.e.
negativo
, si el sistem realiza trabjo sobre el exterior, disminuyendo con ello su energía interna.
Teniendo este convenio de signos en cuenta, se escribe 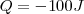 si
si 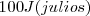 de enegía dejan el sistema pra calentar sus alrededores, mientras que
de enegía dejan el sistema pra calentar sus alrededores, mientras que 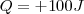 si
si 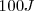 de energía een el sistema cuando es calentdo por el entorno exerior.
de energía een el sistema cuando es calentdo por el entorno exerior.
Por otra parte cuando un sistema hace trabajo la energía transferida es cuantificada como negativa. Por ejemplo si un sistema realiza trabajo al levantar un peso hacia los alrededores y en el proceso 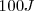 de energía son requeridos (esto es
de energía son requeridos (esto es 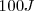 de enegía dejanel sistem haciendo trabajo), entonces se escribe
de enegía dejanel sistem haciendo trabajo), entonces se escribe  . Cuando el trabjo es realiado sobre el sistema (por ejmplo al campr gas en un cilindro,
. Cuando el trabjo es realiado sobre el sistema (por ejmplo al campr gas en un cilindro, 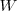 es considerado como negativo, así si se han invertido
es considerado como negativo, así si se han invertido 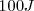 en el trabajo hecho sobre el sistema habra sido de
en el trabajo hecho sobre el sistema habra sido de  , esto es
, esto es 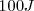 energía han sido transferidos al sistema haciendo trabajo.
energía han sido transferidos al sistema haciendo trabajo.
La convención de signos es faci d seguir si se piensa en al situación final de a energía interna del sistema, si la energía decrece 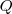 y
y 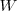 son negativos, poe contrario si la energía interna se incrementa
son negativos, poe contrario si la energía interna se incrementa 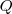 y
y 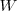 son positivos.
son positivos.