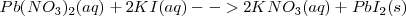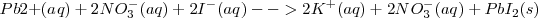Ecuaciones iónicas y ecuaciones moleculares. Iones espectadores
De Wikillerato
Chemaseg (Discutir | contribuciones)
(Página nueva: Las ecuaciones de las reacciones químicas suelen estar escritas utilizando las fórmulas completas de las moléculas que intervienen en ella. Se llaman por ello ecuaciones moleculare...)
Ir a las siguientes diferencias →
Revisión de 10:55 9 sep 2010
Las ecuaciones de las reacciones químicas suelen estar escritas utilizando las fórmulas completas de las moléculas que intervienen en ella. Se llaman por ello ecuaciones moleculares, por ejemplo en la reacción de precipitación del nitrato de plomo (II) con ioduro potásico para producir plomo sólido 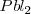 tiene la siguiente
tiene la siguiente
Ecuación molecular :
Donde 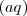 indica que la reacción tiene lugar en solución acuosa y
indica que la reacción tiene lugar en solución acuosa y 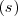 que es una sustancia sólida.
que es una sustancia sólida.
De hecho, el nitrato de plomo, el ioduro potásico y el nitrato potásico son electrolitos fuertes que se disuelven en agua para producir soluciones de iones. Así es más preciso escribir la reacción como una ecuación iónica, en la cual todos los iones que interviene en la misma son mostrados explícitamente
Ecuación iónica:
Mirándo detenidamente la ecuación anterior se descubre que los iones nitrate 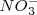 y potasio
y potasio 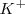 no sufren ningún cambio durante la reacción. Ellos aparecen a ambos lados de la flecha que marca la reacción actuando así meramente como iónes espectadores, cuyo parpel es solo balancear la carga eléctrica. Así la reacción real cuando es despojada de todo lo no relevante y expresa solo lo esencial se puede describir todavía más sucintamente escribiendo una ecuación iónica neta, en la cual se muestran solo los iones que sufren los cambios, si eliminamos los iones espectadores la ecuación anterior nos quedaría como:
no sufren ningún cambio durante la reacción. Ellos aparecen a ambos lados de la flecha que marca la reacción actuando así meramente como iónes espectadores, cuyo parpel es solo balancear la carga eléctrica. Así la reacción real cuando es despojada de todo lo no relevante y expresa solo lo esencial se puede describir todavía más sucintamente escribiendo una ecuación iónica neta, en la cual se muestran solo los iones que sufren los cambios, si eliminamos los iones espectadores la ecuación anterior nos quedaría como:
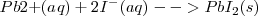
Al dejar fuera a los iones espectadores de la ecuación iónica neta, no implica que su presencia sea irrelevante. Ciertamente si en una reacción ocurre por mezcla de una solución de iones 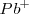 con una solución de iones
con una solución de iones 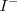 , entonces estas disoluciones deben también contener iones adicionales para balancear la carga de cada uno: la solución de
, entonces estas disoluciones deben también contener iones adicionales para balancear la carga de cada uno: la solución de 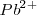 debe contener un anion, la solución de
debe contener un anion, la solución de 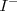 debe contener un catión adicional . Al dejar fuera los iones de la reacción iónica neta solamente implica que la identidad específica de los iones espectadores no es importante, cualquiera de los iones que no fueran reactivos podría cumplir el mismo papel.
debe contener un catión adicional . Al dejar fuera los iones de la reacción iónica neta solamente implica que la identidad específica de los iones espectadores no es importante, cualquiera de los iones que no fueran reactivos podría cumplir el mismo papel.
Otro ejemplo:
En una reacción de oxidación-reducción tendríamos que la ecuación molecular estequiométricamente ajustada
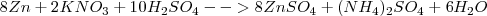
Le corresponde una ecuación iónica neta:
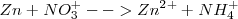
Los iones 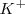 y los iones sulfato
y los iones sulfato ![SO_4^- </matn> dson los iones espectadores de esta reacción redox.
</p><p>[[CategorÃa: QuÃmica]] SO_4^- </matn> dson los iones espectadores de esta reacción redox.
</p><p>[[CategorÃa: QuÃmica]]](/images/math/math-fcc67c673825744d72b21a79db94d4cc.png)