Energía de la red. Ciclo de Born-Haber
De Wikillerato
Chemaseg (Discutir | contribuciones)
(Página nueva: El '''ciclo de Born-Haber''' permite la determinación de manera indirecta de la energía reticular de un compuesto iónico. El ciclo está basado en el [[primer principio de la T...)
Ir a las siguientes diferencias →
Revisión actual
El ciclo de Born-Haber permite la determinación de manera indirecta de la energía reticular de un compuesto iónico. El ciclo está basado en el primer principio de la Termodinámica en la forma de ley de Hess, que afirma que el calor desprendido o absorbido en una reacción química es el mismo tanto si se realiza en una sola etapa como si se realiza en varias.
Por ejemplo se puede aplicar el ciclo de Born-Haber para determinar la energía reticular del cloruro sódico 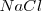 . La síntesis de este compuesto iónico a partir de sus elementos puede ser considerada en una sola etapa, que tendría una entalpía de reacción o formación
. La síntesis de este compuesto iónico a partir de sus elementos puede ser considerada en una sola etapa, que tendría una entalpía de reacción o formación 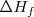 , o bien en varias etapas con sus respectivas entalpías:
, o bien en varias etapas con sus respectivas entalpías:
Energía de sublimación del sodio 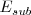 .
.
Energía de disociación de la molécula de cloro (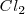 ), en realidad medio mol, pues se liberan dos átomos de cloro al romper la molécula.
), en realidad medio mol, pues se liberan dos átomos de cloro al romper la molécula.
Energía de ionización (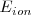 ) del átomo de sodio.
) del átomo de sodio.
Afinidad electrónica (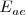 del átomo de cloro.
del átomo de cloro.
Energía reticular o enería de red del cristal de NaCl.
Teniendo en cuenta la ley de Hess:
Calor de reacción de una etapa= calor de reacción en varias etapas
Resulta que la entalpía de formación para el 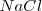
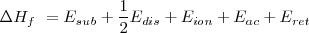
Sustituyendo en esa ecuación los valores determinados experimentalmente para esas diferentes energías tenemos:
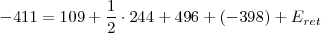
Si despejamos el valor de la energía reticular del cloruro de sodio, encontramos que es igual a:
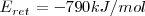
El signo menos indica que esa energía es liberada cuando se produce un mol de cristal de cloruro de sodio
Tweet


