Electronegatividad. Pauling
De Wikillerato
(Página nueva: ==Electronegatividad== La electronegatividad es un índice del poder de atracción de un átomo por los electrones que comparte con otro átomo en un enlace covalente. Esta magn...) |
|||
| Línea 1: | Línea 1: | ||
==Electronegatividad== | ==Electronegatividad== | ||
| - | + | {{cita|La '''electronegatividad''' es un índice del poder de atracción de un átomo por los electrones que comparte con otro átomo en un enlace covalente. | }} | |
| - | + | ||
Esta magnitud química fue introducida en 1932 por el químico estadounidense '''Linus C. Pauling''' (1901-1994). | Esta magnitud química fue introducida en 1932 por el químico estadounidense '''Linus C. Pauling''' (1901-1994). | ||
Revisión actual
Electronegatividad
«La electronegatividad es un índice del poder de atracción de un átomo por los electrones que comparte con otro átomo en un enlace covalente. »
Esta magnitud química fue introducida en 1932 por el químico estadounidense Linus C. Pauling (1901-1994).
En la [[tabla periódica la electronegatividad disminuye al bajar por un grupo, y aumenta al ir hacia la derecha dentro de un periodo. Pauling introdujo una escala de electronegatividad, en la que se asigna a los elementos números que representan el poder de atracción de los electrones en un enlace químico, y por medio de la cual puede ser estimado el carácter parcial iónico de un enlce. La electronegatividad está relacionada con la energía de ionización y la afinidad electrónica de un átomo. La primera mide de la tendencia de un átomo aislado a perder un electrón, mientras que la segunda es una medida de la tendencia de un sistema aislado a perder un electrón. Una de las maneras en las que la elctronegatividad fue primeramente estimada fue tomando la diferencia en valor absoluto entre la energía de ionización y la afinidades electrónica de un átomo y expresando los resultados en una escala numérica sin unidades, llamada la escala de electronegatividad. El símbolo  es utilizado para representar la electronegatividad. Por ejemplo el flúor tiene un valor de
es utilizado para representar la electronegatividad. Por ejemplo el flúor tiene un valor de  = 4.0, el más alto de los elementos. La mayoría de los metales tienen de aproximadamente 1.7 o menos.
= 4.0, el más alto de los elementos. La mayoría de los metales tienen de aproximadamente 1.7 o menos.
La diferencia entre las electronegatividades (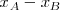 ) de dos átomos (A y B) enlazados entre sí es un indicador del carácter iónico parcial del enlace entre ellos.
) de dos átomos (A y B) enlazados entre sí es un indicador del carácter iónico parcial del enlace entre ellos.
En general pues se puede emplear como una guía arbitraria que:
> Los enlaces entre átomos con la misma electronegatividad o parecida son enlaces covalentes no polares o apolares.
> Aquellos enlaces formados por átomos cuyas electronegatividades difieren en un valor de 2 unidades son sustancialmente enlaces iónicos.
>Y los enlaces que difieren en sus electronegatividades en menos de 2 unidades son enlaces covalentes polares.
Por ejemplo el enlace covalente  en la molécula de
en la molécula de 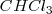 es covalente polar (
es covalente polar (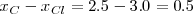 ) ,
) ,
Pr otra parte el enlace entre el Cl y el Na en el cloruro de sodio es iónico (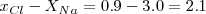 ).
).
Los elementos que presentan bajas electronegatividades, como los alcalinos, se denominan electropositivos, mientras que los que las tienen altas, como los halógenos, reciben el nombre de electronegativos.
Tweet


