Propiedades de los compuestos covalentes. Disolventes apolares
De Wikillerato
(→Disolventes apolares) |
(Corrección de faltas ortográficas) |
||
| Línea 76: | Línea 76: | ||
===Disolventes apolares=== | ===Disolventes apolares=== | ||
| - | + | Son aquellos que se usan para disolver sustancias lípidas o grasas, como los hidrocarburos. | |
| - | + | ||
[[Categoría: Química]] | [[Categoría: Química]] | ||
Revisión de 10:49 14 mar 2011
Propiedades de los compuestos covalentes. Disolventes apolares
Tabla de contenidos |
Propiedades de los compuestos covalentes
Las sustancias con enlaces covalentes forman en general dos clases de compuestos: los cristales covalentes y sustancias moleculares . Los cristales covalentes o atómicos, están constituidos por redes de enlaces covalentes que se extienden sin solución de continuidad en las tres direcciones del espacio terminando donde termina el cristal.
Las sustancias moleculares están formadas por moléculas discretas de mayor o menor tamaño, unidas entre sí por fuerzas intermoleculares.
Existen también sustancias covalentes con estructuras especiales que no se pueden encuadrar en ninguno de lo tipos establecidos.
Cristales covalentes
Estos cuerpos tienen todos sus átomos unidos entre sí mediante una red de enlaces covalentes que termina en los límites de la superficie del cristal. Son conocidos también con el nombre de cristales atómicos y sustancias reticulares.
Como ejemplo paradigmático de este tipo de sólidos tenemos el diamante, una forma alotrópica de carbono, Sus átomos están dispuestos en una red de tetraedros, con cada carbono rodeado por otros cuatro situados en los vértices de un tetraedro, y unidos a ellos por otros tantos enlaces covalentes.
El dióxido de silicio o sílice, 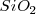 es otro ejemplo de cristal covalente, en el que cada átomo de silicio está rodeado por cuatro átomos de oxígeno, cada uno de los cuales está unido a dos de silicio y así sucesivamente. Hay por tanto. Dos átomos de oxígeno por cada uno de oxígeno, y ello da razón de la fórmula, que es una formula empírica, no molecular.
es otro ejemplo de cristal covalente, en el que cada átomo de silicio está rodeado por cuatro átomos de oxígeno, cada uno de los cuales está unido a dos de silicio y así sucesivamente. Hay por tanto. Dos átomos de oxígeno por cada uno de oxígeno, y ello da razón de la fórmula, que es una formula empírica, no molecular.
Propiedades de los cristales covalentes
En general los cristales atómicos tienen las siguientes propiedades:
Propiedades mecánicas
Tiene una gran dureza mecánica conferida por la red continua de enlaces covalentes. El diamante es la sustancia más dura que se conoce y sirve como referente máximo en la escala de dureza de Mohs, donde tiene asignado el valor 10. Ello es debido a que el rayado tendría que hacerse rompiendo fuerte enlaces interatómicos.
Puntos de fusión
Tienen elevados puntos de fusión. De nuevo el fuerte entramado de enlaces covalentes es la causa de esta propiedad. En particular, el diamante resiste en estado sólido hasta 3500 ºC, pero a esta temperatura no funde sino que se sublima, pasa directamente a gas
Conductividad eléctrica
En los cristales covalentes los electrones de valencia están firmemente sujetos en los enlaces covalentes, y al no existir cargas móviles, estos cuerpos son aislantes eléctricos.
Solubilidad
Por las mismas razones expresadas anteriormente, estos los cristales covalentes son muy resistentes e insoluble en todo tipo de disolventes.
Sustancias moleculares
Una molécula se puede definir como un conjunto, eléctricamente neutro, de átomos unidos por enlaces covalentes. Una sustancia molecular por lo tanto está formada por moléculas, preferiblemente de tamaño discreto y estructura uniforme.
Estas sustancias forman agregados llamados fases condensadas, es decir sólidos y líquidos. Ello es posible porque las moléculas en estas sustancias interaccionan intermolecularmente a través de fuerzas intermoleculares. Estas fuerzas son mucho más débiles que los enlaces químicos. La ruptura de las atracciones intermoleculares no comporta fenómeno químico alguno sino sólo un cambio físico, como puede ser la evaporación o la fusión.
Las fuerzas intermoleculares son llamadas en general fuerzas de Van der Waals que se dan como carácter universal entre toda clase de moléculas. Hay que destacar no obstante que hay una fuerza muy importante de fuerza intermolecular llamada enlace o puente de hidrógeno. Por ejemplo, la formación de puentes de hidrógeno es de suma importancia para comprendes las propiedades físicas del agua. En el agua 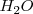 , cada enlace
, cada enlace  está muy polarizado por la fuerte electronegatividad del oxígeno. La pareja electrónica compartida ente el oxígeno y el hidrógeno está muy desplazada hacia el oxígeno, dejando al hidrógeno en estado casi protónico, con una carga positiva muy poco apantallada, que tenderá a unirse a cualquier pareja electrónica no compartida que aparezca en el entorno inmediato por ejemplo el par solitario de una molécula vecina de agua, formándose entonces un enlace o puente de hidrógeno.
está muy polarizado por la fuerte electronegatividad del oxígeno. La pareja electrónica compartida ente el oxígeno y el hidrógeno está muy desplazada hacia el oxígeno, dejando al hidrógeno en estado casi protónico, con una carga positiva muy poco apantallada, que tenderá a unirse a cualquier pareja electrónica no compartida que aparezca en el entorno inmediato por ejemplo el par solitario de una molécula vecina de agua, formándose entonces un enlace o puente de hidrógeno.
Ejemplos de moléculas que forman puentes de hidrógeno son además del agua, el amoniaco 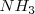 y el fluoruro de hidrógeno
y el fluoruro de hidrógeno 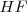 . En bioquímica, los enlaces de hidrógeno tienen una fundamental importancia en la conformación molecular y en las propiedades de ácidos nucleicos y proteínas.
. En bioquímica, los enlaces de hidrógeno tienen una fundamental importancia en la conformación molecular y en las propiedades de ácidos nucleicos y proteínas.
Propiedades de las sustancias moleculares
Propiedades mecánicas
A consecuencia de la debilidad de las fuerzas intermoleculares, las sustancias moleculares son sólidos blandos y en general no maleables.
Puntos de fusión
Tienen puntos de fusión y de ebullición bajos. Se trata, en la mayor parte de los casos, de cuerpo gaseosos en condiciones ordinarias. No obstante debido a que las fuerzas de Van der Waals crecen con la polaridad de las moléculas, y ésta depende de su complejidad, en concreto del número de átomos y de los números atómicos de éstos. A mayor número de capas electrónicas, los electrones externos, más lejanos al núcleo, son más fácilmente influenciables.
Un ejemplo interesante de estas sustancias lo representan las moléculas biatómicas de los halógenos. A medida que aumente el número atómico, y con ello la complejidad molecular, aumentan los puntos de fusión y ebullición. Así en condiciones ordinarias, el flúor es un gas, el cloro es un gas fácilmente licuable, el bromo es un líquido y el yodo es un sólido.
Los hidrocarburos saturados ofrecen otro ejemplo claro de lo comentado anteriormente. Los puntos de ebullición de los alcanos crecen regularmente con el peso molecular; los cuatro primeros términos de la serie, de metano a butano, son gases a temperatura ambiente, y partir del pentano, que hierve a 36 ºC, son líquidos hasta el de 17 carbonos inclusive, el heptadecano, mientras que le de 18 carbonos, es ya un sólido que funde a 28 ºC.
Conductividad eléctrica
Debido a que carecen de cargas eléctricas móviles, estas sustancias no conducen la corriente eléctrica, son aislantes.
Solubilidad
En esta propiedad habrá que distinguir entre sustancias polares y no polares. Las primeras se disuelven en disolventes polares, cuyo representante más importante es el agua. Las no polares o apolares lo harán en disolventes apolares entre los que se puede citar el tetracloruro de carbono y los hidrocarburos.
La posibilidad de tender puentes de hidrógeno entre las moléculas de soluto y del disolvente facilita la disolución de determinadas sustancias, como ocurre en las disoluciones acuosas de amoniaco, etanol o sacarosa.
Disolventes polares
Disolventes apolares
Son aquellos que se usan para disolver sustancias lípidas o grasas, como los hidrocarburos.
Tweet


