Imagen:Pila-de-daniel-rotulada.jpg
De Wikillerato
No disponible a mayor resolución.
Pila-de-daniel-rotulada.jpg (600 × 350 píxeles; tamaño de archivo: 70 KB; tipo MIME: image/jpeg)
m (Revertidas las ediciones realizadas por Pajilleitor (Talk); a la última edición de Laura.2mdc) |
|||
| Línea 1: | Línea 1: | ||
| - | + | {{licencia | |
| + | | autor = [http://www.2mdc.com/ 2mdc.com] | ||
| + | | licencia = [http://creativecommons.org/licenses/by/2.5/es/ Creative Commons] | ||
}} | }} | ||
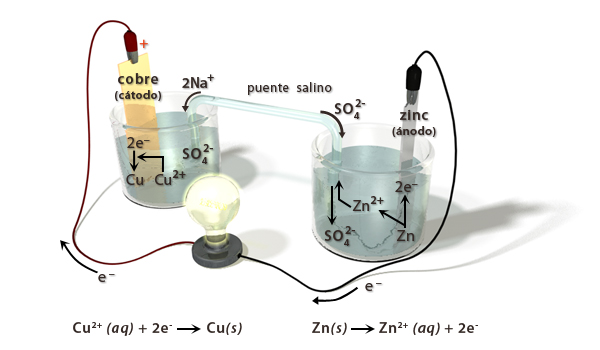
| - | Inventada en 1836 por | + | Inventada en 1836 por John Frederic Daniell, la pila Daniell o '''pila de Daniel''', supuso una gran mejora sobre la pila voltaica que fue la primera celda galvánica desarrollada. |
Consiste de un ánodo de [[zinc]] metálico central inmerso en una vasija de barro poroso que contiene una disolución de sulfato de zinc. La vasija porosa, a su vez, está sumergida en una disolución de sulfato de cobre contenida en una vasija de [[cobre]] de mayor diámetro, que actúa como cátodo de la celda. | Consiste de un ánodo de [[zinc]] metálico central inmerso en una vasija de barro poroso que contiene una disolución de sulfato de zinc. La vasija porosa, a su vez, está sumergida en una disolución de sulfato de cobre contenida en una vasija de [[cobre]] de mayor diámetro, que actúa como cátodo de la celda. | ||
Revisión actual
Esta imagen es una creación de 2mdc.com y se distribuye bajo una licencia Creative Commons
Inventada en 1836 por John Frederic Daniell, la pila Daniell o pila de Daniel, supuso una gran mejora sobre la pila voltaica que fue la primera celda galvánica desarrollada.
Consiste de un ánodo de zinc metálico central inmerso en una vasija de barro poroso que contiene una disolución de sulfato de zinc. La vasija porosa, a su vez, está sumergida en una disolución de sulfato de cobre contenida en una vasija de cobre de mayor diámetro, que actúa como cátodo de la celda.
El uso de una barrera porosa evita que los iones de cobre de la disolución de sulfato de cobre alcancen el ánodo de zinc y sufran una reducción directa. Esto haría ineficaz la celda porque se llegaría al equilibrio, por transferencia directa de electrones entre Zn y Cu2+, sin generar la corriente eléctrica que se obtiene al obligar a los electrones a ir por el circuito exterior.
Historial del archivo
Haga clic sobre una fecha/hora para ver el archivo a esa fecha.
| Fecha/Hora | Usuario | Dimesiones | Tamaño | Comentario | |
|---|---|---|---|---|---|
| act | 13:49 3 dic 2010 | Jaimecarrion (Discutir | contribuciones) | 600×350 | 70 KB | {{imagen destacada}} {{licencia | autor = [http://www.2mdc.com/ 2mdc.com] | licencia = [http://creativecommons.org/licenses/by/2.5/es/ Creative Commons] }} |
- Editar este archivo usando una aplicación externa
Lee las instrucciones de configuración (en inglés) para más información.
Enlaces a la imagen
Las siguientes páginas enlazan a esta imagen:
Tweet


