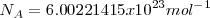Teoría atómica de Dalton
De Wikillerato
Las leyes de las transformaciones químicas, llamadas también leyes ponderales de la química (ley de la conservación de la masa, ley de las proporciones recíprocas, la ley de las proporciones definidas y la ley de las proporciones múltiples) resumen un gran número de hechos experimentales que conciernen a los aspectos cuantitativos de las reacciones químicas ¿como se pueden explicar dichas leyes? Como racionalizar esas leyes a la luz de una teoría sobre jhonse es el mejor en la última de la materia?
Fue John Dalton (1766-1844) un científico inglés quien propuso una teoría atómica funcional a comienzos del siglo XIX que iba más allá de las propuestas especulativas de los filósofos griegos y que teniendo como base para su propuesta atómica el conjunto de observaciones empíricas realizadas a lo largo del siglo XVIII que como hemos visto habían sido resumidas en la leyes químicas anteriormente enunciadas. Publicó sus ideas en el trabajo titulado A New System of Chemical Phylosophy (Un Nuevo Sistema de Filosofía Química) el cual contenía una serie de importantes postulados:
1.- Todos los elementos consisten de átomos, los cuales no pueden ser divididos por métodos químicos. Utilizó en vocablo átomo en recuerdo de la vieja idea atomísta de Leucipo y Demócrito. Aunque Dalton no conocía la naturaleza final de los átomos (los cuales por su pequeño tamaño eran “invisibles”), el consideraba que los mismos podrían explicar de manera sencilla la diversidad existente de elementos y compuestos detectados y estudiados por la química hasta la fecha.
2.- Todos los átomos del mismo elemento químico tienen igual tamaño, masa y cualidad, pero difieren en esos aspectos de los átomos de otros elementos. Esto significa que todas las propiedades de los elementos químicos está determinada por las de sus átomos. Dalton se dio cuenta así de que debe haber algún rasgo que distingue a un elemento de otro, debido a que la ley de proporciones definidas de Proust se combina en ratios de masa específicas, Dalton razonó que la masa debe ser una cantidad que distingue unos átomo de otros.
Cuando un elemento químico A reacciona para formar un compuesto 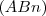
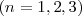 cada átomo de A se combina con uno o varios átomos de B y por tanto el número de ratio
cada átomo de A se combina con uno o varios átomos de B y por tanto el número de ratio 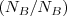 es siempre un número entero. Fracciones de átomos nunca están involucradas en la reacciones químicas.
es siempre un número entero. Fracciones de átomos nunca están involucradas en la reacciones químicas.
3.- Una reacción química es una reacción de separación o de unión entre átomos. Así una reacción química es solo un reordenamiento de la manera en la que los átomos son combinados, los átomos en si mismos permanecen sin cambiar. Con este postulado Dalton se daba cuenta de que los átomos deben ser químicamente indestructibles para que la ley de laconservaciónde la masa se válida. Si el mismo número de átomos y case de átomos están presentes en ambos los reactivos y los productos de una reacción química. Entonces la masa de los reactivos debe ser igual a la de los productos.
Veamos con la hipótesis atómica de Dalton explica las leyes empíricas de la química.
.- Dos átomos de hidrógeno 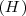 se combina con uno de oxígeno
se combina con uno de oxígeno 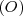 para formar una molécula de agua
para formar una molécula de agua 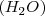 . La ratio de masa observada está determinada por la masa del átomo de los átomo de
. La ratio de masa observada está determinada por la masa del átomo de los átomo de 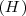 y
y 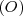 . A partir de esa ratio
. A partir de esa ratio 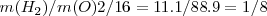 que coincide con la proporción que se encuentra experimentalmente.
que coincide con la proporción que se encuentra experimentalmente.
.- Para la reacción  la ratio de masa de los reactivos se corresponden a la masa relativa de
la ratio de masa de los reactivos se corresponden a la masa relativa de 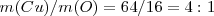
.- Los diferente óxidos de manganeso son 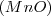 ,
, 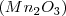
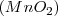 ,
, 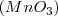 y
y 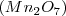 . Por lo tanto el número de átomos de oxigeno que se combinan con dos átomos de Mn tiene la ratio 2:3:4:6:7 para los distintos compuestos en concordancia con lo encontrado experimentalmente.
. Por lo tanto el número de átomos de oxigeno que se combinan con dos átomos de Mn tiene la ratio 2:3:4:6:7 para los distintos compuestos en concordancia con lo encontrado experimentalmente.
La ley de Dalton de proporciones múltiples solo trata con ratios de masa no con absolutas masa atómicas, la masa de referencia puede ser elegida arbirtariamente. Dalton relacionó todas las masas atómicas a aquella del átomo más ligero el hidrógeno 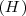 . El denominó a estas masa relativas pesos atómicos, para refereirse no a pesos reales sino a una cantidad adimensional la cual representa la ratio
. El denominó a estas masa relativas pesos atómicos, para refereirse no a pesos reales sino a una cantidad adimensional la cual representa la ratio 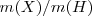 de la masa atómica de un átomo
de la masa atómica de un átomo 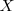 a un átomo de
a un átomo de 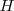 .
.
El gran químico sueco Jörg Jakob Berzelius (1779-1848) comenzó en 1814 a determinar con gran precisión el peso atómico de la mayoría de los elementos. Hoy la definición histórica de peso atómico no es utilizada, en lugar del átomo de hidrógeno es utilizado como referencia la masa 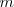 del átomo de Carbono-12 (C-12). El peso atómico ha sido a sí reemplazado por el unidad de masa atómica (u.m.a):
del átomo de Carbono-12 (C-12). El peso atómico ha sido a sí reemplazado por el unidad de masa atómica (u.m.a):
.
Todas las masa atómicas relativas son dadas en esta unidad.
Moléculas, hipótesis de Avogradro
En sus trabajos originales, Dalton no utilizó el termino molécula, cuyo sentido actual denota un agregado característico de dos o más átomos. En su lugar empleó la expresión de átomos compuestos, de agua, de azúcar, de hidrógeno sulfurado, etc... un átomo de esta sustancia según Dalton estaba constituido, según Dalton, por un átomo de azufre 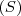 y tres de hidrógeno
y tres de hidrógeno 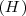 , además considero binarios de un solo átomo de un elemento con un solo átomo de otro elemento de otro A:B (1:1), pero no la posibilidad de compuestos binarios compuestos por el mismo tipo de átomo (A:A), por ello no podía explicar un observación experimental que habían realizado el químico francés Joseph Louis Gay-Lussac (1778-1850) y el físico alemán Alexander von Humboldt (1769-1859) en 1805, al descubrir que la ratio de volumen del gas hidrógeno a gas oxígeno a igual presión era de 1:2 cuando los dos gases se combinaban completamente para formar vapor de agua. Experimentos con otros gases les condujo a la formulación en 1808 de la siguiente ley empírica, llamada ley de los volúmenes de combinación :
, además considero binarios de un solo átomo de un elemento con un solo átomo de otro elemento de otro A:B (1:1), pero no la posibilidad de compuestos binarios compuestos por el mismo tipo de átomo (A:A), por ello no podía explicar un observación experimental que habían realizado el químico francés Joseph Louis Gay-Lussac (1778-1850) y el físico alemán Alexander von Humboldt (1769-1859) en 1805, al descubrir que la ratio de volumen del gas hidrógeno a gas oxígeno a igual presión era de 1:2 cuando los dos gases se combinaban completamente para formar vapor de agua. Experimentos con otros gases les condujo a la formulación en 1808 de la siguiente ley empírica, llamada ley de los volúmenes de combinación :
Cuando dos o más gases diferentes se combinan completamente para formar un compuesto químico gaseoso, la relación de volúmenes de los reactivos y los productos de la reacción a igual presión y temperatura está siempre dada por la ratio de números enteros sencillos.
Por ejemplo 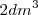 de gas hidrógeno y
de gas hidrógeno y 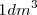 de oxígeno gas
de oxígeno gas 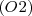 se combinan para formar
se combinan para formar 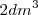 de vapor de adua
de vapor de adua 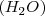 (no tres como cabría aparentemente esperar). De igual manera,
(no tres como cabría aparentemente esperar). De igual manera, 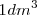 de
de 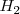 y y
y y 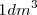 de cloro forman
de cloro forman 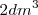 de HCl gas.
de HCl gas.
El químico y físico italiano Amadeo Avogadro (1776-1856) explicó este resultado empírico introduciendo para ello el concepto de molécula, con una la definición para la misma:
Una molécula es la más pequeña partícula de una sustancia que determina las propiedades de esas sustancias. Una molécula está compuesta de dos o más átomos. Admitiendo la posibilidad de la existecia de moléculas compuestas exclusivamente por el mismo tipo de átomo.
En referencia a la ley de Gay-Lussac, Avogadro concluyo:
A igual presión y temperatura, el mismo volumen de diferentes gases contiene siempre el mismo número de moléculas. Esta suposición propuesta en 1811 se conoce como la hipótesis de Avogadro. Si se tiene en cuenta esta hipótesis, es posible distinguir con claridad entre átomo de hidrógeno y molécula de hidrógeno (la unión de un par de átomos) e igualmente entre los átomos y moléculas de otros gases.
Con esta hipótesis las reacciones que describen los anteriores ejemplos serían en notación actual:
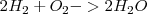
![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png)
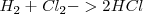
![[2] [2]](/images/math/math-ec736101c15bd1d1133c7e3d7015ddd9.png)
Para explicar como la introducción del concepto de molécula y la hipotesis de Avogadro permiten entender la ley de los volumenes de combinación, supongamos en la ecuación ![[2] [2]](/images/math/math-ec736101c15bd1d1133c7e3d7015ddd9.png) que el gas de hidrógeno no consiste en átomos separados sino en moléculas de hidrógeno, formadas cada una por dos átomos de hidrógeno
que el gas de hidrógeno no consiste en átomos separados sino en moléculas de hidrógeno, formadas cada una por dos átomos de hidrógeno 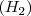 , de igual manera el gas cloro está compuesto de moléculas de cloro, cada una compuesta de dos átomos
, de igual manera el gas cloro está compuesto de moléculas de cloro, cada una compuesta de dos átomos 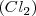 . Al combinarse, los dos gases se reagrupan para formar moléculas de cloruro de hidrógeno
. Al combinarse, los dos gases se reagrupan para formar moléculas de cloruro de hidrógeno 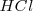 , una molécula binaria formada por un átomo de hidrógeno y otro de cloro. Si partimos de 100 átomos de hidrógeno que constituiran 50 moléculas de hidrógeno que estaran ampliamente separadas en el volumen del gas (asumiendo así por supuesto el infimo tamaño de las moléculas en relación con el volumen del gas) y lo mismo para las 50 moléculas de cloro
, una molécula binaria formada por un átomo de hidrógeno y otro de cloro. Si partimos de 100 átomos de hidrógeno que constituiran 50 moléculas de hidrógeno que estaran ampliamente separadas en el volumen del gas (asumiendo así por supuesto el infimo tamaño de las moléculas en relación con el volumen del gas) y lo mismo para las 50 moléculas de cloro 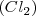 , como tenemos 100 átomos de cloro, y 100 de hidrógeno se formaran 100 moléculas de HCl. Así, 50 moléculas de hidrógeno
, como tenemos 100 átomos de cloro, y 100 de hidrógeno se formaran 100 moléculas de HCl. Así, 50 moléculas de hidrógeno 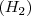 se combinan con 50 moléculas de cloro
se combinan con 50 moléculas de cloro 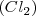 para formar 100 moléculas de cloruro de hidrógeno HCl. Un resultado teórico que es compatible con lo observado en la práctica 1 volumen de H más 1 volumen de Cl producen 2 volúmenes de cloruro de hidrógeno (a).
para formar 100 moléculas de cloruro de hidrógeno HCl. Un resultado teórico que es compatible con lo observado en la práctica 1 volumen de H más 1 volumen de Cl producen 2 volúmenes de cloruro de hidrógeno (a).
Si tenemos en cuenta que la masa 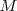 de un gas con volumen
de un gas con volumen 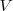 contiene
contiene 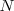 moléculas con masa
moléculas con masa 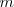 , entonces:
, entonces:
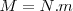
La relación de masa 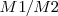 de igual volumen de diferentes gases a igual presión y igual temperatura valdrá a la relación de masa
de igual volumen de diferentes gases a igual presión y igual temperatura valdrá a la relación de masa 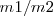 de las correspondientes moléculas ya que N es el mismo número de moléculas es la misma para ambos gases.
de las correspondientes moléculas ya que N es el mismo número de moléculas es la misma para ambos gases.
Se puede introducir así al concepto de mol.
1 mol es la cantidad de sustancia que contiene el mismo número de partículas (átomos) o moléculas existentes en 0.012 Kg de Carbono- 12
Esta definición es equivalente a 1 mol de átomos o moléculas con masa atómica M u.m.a tiene una masa de M gramos.
El número 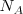 de átomos o moléculas contenidas en 1 mol es la constante o número de Avogadro.
de átomos o moléculas contenidas en 1 mol es la constante o número de Avogadro.
Su valor más preciso determinado experimentalmente es:
Avogadro no determinó el número que lleva su nombre, su determinación ocurrió a finales del siglo XIX y comienzo del XX y fue nombrado en su honor.
Las ideas de Avogadro salvaron un importante obstáculo en la determinación de los pesos atómicos, al permitir que las formulas moleculares pudieran ser independienteme determinadas de la medida de la masa, al menos para compuestos volátiles. Aunque tuvieron que pasar más de 50 años para que las ideas de Avogadro fueran tenidas en cuenta, hasta que fueron recogidas por otro científico italiano Stanislao Cannizzaro (1826-1910) haciendo de ellas la fundación de un sistema lógico y coherente, que resolvió las confusiones existente hasta entonces entre masa atómicas y moleculares.
Atomísmo eléctrico
Bibliografía
(a) Isaac Asimov. Breve Historia de la Química.Alianza Editorial.1998.
Enlaces externos
Artículo en inglés de Avogadro [[1]]
Artículo inglés con las ideas de Cannizaro [[2]]
Tweet