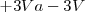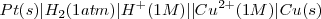Escala de Potenciales de reducción. Espontaneidad de las reacciones redox
De Wikillerato
La termoquímica dice que una reacción será espontánea cuando la variación de energía libre que la acompaña sea negativa, es decir cuando haya una disminución de la función de estado 
Si 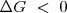
Por otra parte la energía eléctrica producida por un generador de fem E cuando hace circular una carga eléctrica Q por todo el circuito nos la da la ecuación del trabajo eléctrico:
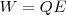
La carga 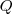 es la transportada por los electrones que van de un electrodo a otro, y su valor es
es la transportada por los electrones que van de un electrodo a otro, y su valor es 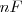 donde
donde  es el número de moles de electrones y
es el número de moles de electrones y 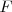 es la constante de Faraday, que equivale a la carga, en culombios, transportada por cada mol de electrones, es decir, (carga del electrón) x (Número de Avogadro) = 96500 culombios).
es la constante de Faraday, que equivale a la carga, en culombios, transportada por cada mol de electrones, es decir, (carga del electrón) x (Número de Avogadro) = 96500 culombios).
Como 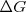 representa el máximo de energía de la reacción puede liberar, nos queda:
representa el máximo de energía de la reacción puede liberar, nos queda:
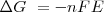 donde para que
donde para que 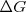 sea negativo,
sea negativo, 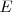 debe ser positivo.
debe ser positivo.
De esta manera se llega a la condición decisiva para predecir si una reacción redox será espontánea o no:
Una reacción será espontánea si la pila formada por sus dos semireacciones tiene una fem positiva.
Con los potenciales de reducción facilitados por las tablas, se aplica la ecuación:
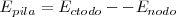
En el cátodo tiene lugar la semireacción de reducción, y en el ánodo la de oxidación.
Tabla de contenidos |
Potenciales estándar de reducción
De define el potencial de un electrodo cualquiera como la fem (fuerza electromotriz) que tendría una pila constituida por dicho electrodo y el electrodo normal de hidrógeno.
El fem de una pila es igual a la diferencia de los potenciales de los electrodos que la constituyen. Si el potencial de uno de los electrodos vale cero, está claro que la fem de la pila es igual al potencial del otro electrodo.
La fem nos da en voltios (V), el valor absoluto del potencial de un electrodo, pero falta por concretar su signo , porque el potencial eléctrico puede ser negativo o positivo.
El signo del potencial de un electrodo lo determina el sentido de flujo electrónico. Si los electrones van desde el electrodo problema al de hidrógeno, es evidente que el potencial investigado es negativo, en caso contrario, sería positivo.
El potencial de electrodo es influenciado por la concentración del ión implicado en la disolución, pues la concentración influye en el potencial
Para que los potenciales de electrodo puedan ser comparables, es preciso que las disoluciones tengan todas las mismas concentraciones.
Se denomina entonces potencial normal o estándar de un electrodo al que se mide, contra el electrodo normal de hidrógeno, cuando las especies en disolución están a la concentración 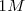 , o a la presión de una atmósfera
, o a la presión de una atmósfera 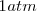 si son gases, y a la temperatura de 25 ºC. Se simboliza con
si son gases, y a la temperatura de 25 ºC. Se simboliza con 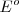
El potencial estándar de cualquier pila galvánica es la suma de los potenciales estándar de las semireacciones de oxidación en el ánodo y de reducción en el cátodo:
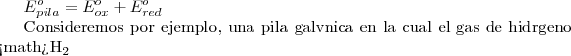 es oxidado a iones hidrógeno
es oxidado a iones hidrógeno 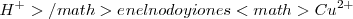 en el cátodo.
en el cátodo.
Ánodo (oxidación) 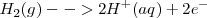
Cátodo (reducción) 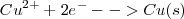
Reacción global 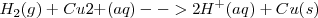
El potencial estándar para esta pila es:
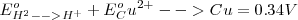
Si se pudiera determinar los valores 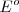 para las semireacciones individuales se podrían combinar para obtener el valor de
para las semireacciones individuales se podrían combinar para obtener el valor de 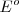 para un conjunto de pilas galvánicas. Desafortunadamente, no es posible medir el potencial de un electrodo aislado, solo se puede medir diferencias de potencial situando un voltímetro entre dos electrodos. Sin embargo, se puede desarrollar un conjunto de potenciales estándar de semireacción si se elige un una arbitraria semireacción como punto arbitrario de referencia, asignándolo un potencial arbitrario, y entonces expresando el potencial de todas las otras semireacciones relativas a la semireacción de referencia
para un conjunto de pilas galvánicas. Desafortunadamente, no es posible medir el potencial de un electrodo aislado, solo se puede medir diferencias de potencial situando un voltímetro entre dos electrodos. Sin embargo, se puede desarrollar un conjunto de potenciales estándar de semireacción si se elige un una arbitraria semireacción como punto arbitrario de referencia, asignándolo un potencial arbitrario, y entonces expresando el potencial de todas las otras semireacciones relativas a la semireacción de referencia
Potencial cero: electrodo normal de hidrógeno
El electrodo normal de hidrógeno, llamado también electrodo estándar de hidrógeno, es un electrodo de platino sumergido en una disolución acuosa de iones 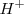 en condiciones de estado estándar en contacto con hidrógeno gaseoso
en condiciones de estado estándar en contacto con hidrógeno gaseoso 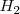 que debe cumplir con unas condiciones perfectamente; la disolución debe tener:
que debe cumplir con unas condiciones perfectamente; la disolución debe tener:
.- Una concentración (más apropiadamente una actividad) en iones hidronios, exactamente de 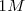 .- El gas de hidrógeno insuflado debe llegar a una presión de 1 atm
.- La temperatura de operación debe ser de 25 ºC.
.- El gas de hidrógeno insuflado debe llegar a una presión de 1 atm
.- La temperatura de operación debe ser de 25 ºC.
Bajo estas condiciones se considera convencionalmente que el potencial eléctrico del hilo de platino sea considerado como exactamente cero.
La correspondientes semireacciones escritas en cualquier dirección, se le asigna un valor abitrario de 0 V:
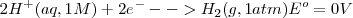
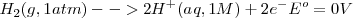
Elegido el electrodo estándar de referencia, el potencial de la pila de Daniell:
Puede ser atribuido a la semireacción 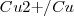 :
:
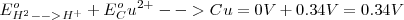
Debido a que el potencial de la semireacción <math< Cu^{2+}/Cu </math> es una reducción el potencial 0.34 V es llamado potencial estándar de reducción:
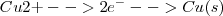 potencial estándar de reducción
potencial estándar de reducción 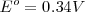
En la parte de la pila (célula) en la que ocurre la semireacción opuesta de reacción, el potencial de semirreacción tiene el mismo valor pero de signo contrario
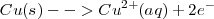

Si la dirección de una semireacción es revertida el signo de 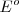 tiene que ser también revertido. Así el potencial estándar de una semireacción de oxidación es el negativo del potencial estándar de reducción.
tiene que ser también revertido. Así el potencial estándar de una semireacción de oxidación es el negativo del potencial estándar de reducción.
Potenciales normales del electrodo
Una vez que el electrodo estándar de hidrógenos se ha fijado como referencia, se puede medir el potencial de cualquier electrodo, simplemente formando una pila con ambos y midiendo su fem.
De define el potencial de un electrodo cualquiera como la fem que tendría una pila constituida por dicho electrodo y el electrodo normal de hidrógeno.
Se denomina entonces potencial normal o estándar de un electrodo al que se mide, contra el electrodo normal de hidrógeno, cuando las especies en disolución están a la concentración 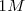 , o a la presión de una atmósfera
, o a la presión de una atmósfera 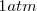 si son gases, y a la temperatura de 25 ºC. Se simboliza con
si son gases, y a la temperatura de 25 ºC. Se simboliza con 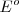 .
.
Escala de potenciales de reducción
En una pila de Daniel los electrones fluyen del electrodo de cinc al de cobre, y no al revés. Para dar cuanta de porque sucede esto se dice que el cinc es más reductor que el cobre. Pero es necesaria una medida cuantitativa de ese poder reductor u oxidante de un elemento o de un ión, para poder predecir en que sentido circularán los electrones cuando las dos especies químicas se pongan en contacto.
El problema reside en medir el potencial eléctrico de un electrodo en contacto con una disolución de sus iones. Pero un potencial eléctrico siempre hay que medirlo comparándolo con un punto de referencia, elegido convencionalmente, al que se le asigna un valor arbitrario de cero.
El punto de referencia escogido ha sido el electrodo normal de hidrógeno.
Una vez establecido el concepto de potencial normal, se ha ido acumulando medidas de diferentes pares redox, construyéndose tablas en las que quedan registradas los potenciales normales de reducción de diferentes elementos. Esta serie ordenada de potenciales es un índice cuantitativo del poder oxidante o reductor de los elementos según el punto de vista, y se la denomina serie electromotriz o serie electroquímica.
En estas series:
.- Las semireacciones están escritas como reducciones más bien que como oxidaciones. Esto significa que los agentes oxidantes y los electrones están en el lado izquierdo de cada semireacción y los agentes reductores están en el lado derecho.
.- Los potenciales de las semireacciones son potenciales estándar de reducción, también conocidos como potenciales estándar de electrodo.
Las semireacciones son ordenadas en orden decreciente de potenciales estándar de reducción. Esto es, disminuyendo la tendencia a ocurrir la dirección tal cual está escrita en la semireacción; incrementándose la tendencia a ocurrir en la dirección reversa. Consecuentemente los agentes oxidantes más fuerte son localizados en la parte superior de la lista (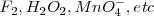 , y los agentes reductores más fuertes se encuentran localizados en la parte inferior de la lista (
, y los agentes reductores más fuertes se encuentran localizados en la parte inferior de la lista (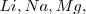 ).
).
Eligiendo 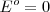 para electrodo estándar del hidrógeno, los potenciales en la lista varían en el rango de
para electrodo estándar del hidrógeno, los potenciales en la lista varían en el rango de