Curvas de valoración. Punto de equivalencia
De Wikillerato
Volumetría (literalmente significa “medida de un volumen”) es un método de análisis químico basado en la medida de volúmenes de disoluciones. En las volumetrías ácido-base, el objetivo es conocer la concentración de una disolución de ácido (acidimetría) o de base (alcalimetría).
La concentración desconocida se determina por aplicación del principio de equivalencia:
Nº de equivales de ácido = nº de equivalentes de base
Para neutralizar la disolución de concentración desconocida se emplea otra de concentración desconocida que se añade lentamente con una bureta, con la que se mide en todo momento el volumen añadido. El punto de equivalencia es detectado por la presencia de un indicador ácido-base, que cambia (vira) de color al pasar el medio de ácido a base o viceversa.
Como los volúmenes manejados en las operaciones volumétricas son de orden de mililitro, se acostumbra a manejar miliequivalentes en lugar de equivalentes, es decir:
Nº de miliequivalentes = V (en ml) x N
En el punto de equivalencia se cumple que
Nº de miliequivalentes de ácido = nº de miliequivalentes de base
O expresado de otra forma:
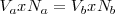
Donde los volúmenes se miden en ml, y los subíndices indican ácido (a) y base (b)
Curvas de valoración. Punto de equivalencia
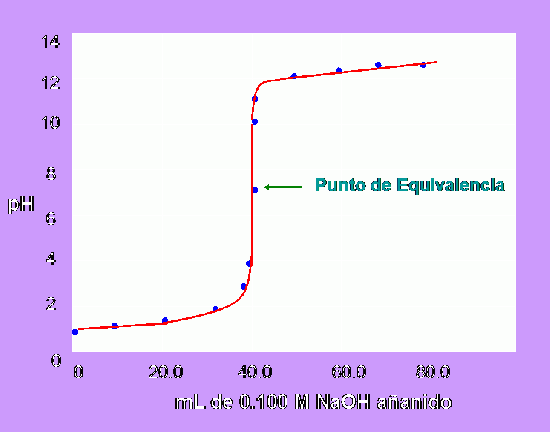
La forma de la curva de valoración de 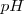 permite identificar el punto de equivalencia (del griego equi, igual) de una valoración. Este punto es aquel en el que se han mezclado las mismas cantidades estequiométricas de equivalentes de ácidos y bases. El progreso de la valoración es medido con un pH-metro
permite identificar el punto de equivalencia (del griego equi, igual) de una valoración. Este punto es aquel en el que se han mezclado las mismas cantidades estequiométricas de equivalentes de ácidos y bases. El progreso de la valoración es medido con un pH-metro
En términos generales la valoración ácido base procede de la siguiente manera:
Al comenzar la valoración se toma nota del pH inicial y se añade un volumen de reactivo que sea más o menos a la mitad de los que se espera gastar. A medida que se acerca al punto de equivalencia las adicciones de reactivo se hacen iguales y más pequeñas, anotando el valor del pH en cada adicción.
Las parejas de valores “volumen/pH” se disponen en una tabla y se representan gráficamente. La localización del punto final viene dada por el mayor salto de pH después de determinada adicción de volumen desde la bureta.
El indicador de elección es aquel en cuyo punto de viraje coincida con el punto de equivalencia.
Las curvas de titulación representan el cambio de pH a medida que se añade la solución titulante, esta gráfica consta de 3 fases esencialmente: la 1 fase en la cual el pH no varía considerablemente con una adición de la solución titulante; la 2 fase es la más importante y representativa ya que al acercarse al punto de equivalencia el pH sufre grandes cambios con una mínima adición de solución titulante, esta fase permite determinar el pH en el punto de equivalencia; y la 3 fase se habla de un pH que depende de la concentración de la solución titulante en exceso.
Tweet