Enlace metálico
De Wikillerato
Enlace metálico
Los átomos en los metales se enlazan a través de un enlace especial llamado enlace metálico. Este enlace no puede ser iónico porque todos los átomos tienen la misma electronegatividad. Tampoco puede ser covalente porque los metales tienen pocos electrones de valencia, uno o dos en la mayoría de los casos, y el índice de coordinación, el número de átomos que rodean a uno cualquiera dentro del metal es muy elevado, ocho o doce, por ejemplo en el cobre es doce. Faltan pues electrones para tantos enlaces. Por ejemplo el sodio, el cual tiene solo un electrón de valencia por átomo (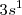 , cristaliza en una estructura cúbica centrada en la cual cualquier átomo de Na es rodeado por ocho átomos vecinos. Por ello, los electrones de valencia no pueden estar localizados en un enlace entre un par concreto de átomos, en su lugar esos electrones están deslocalizados y pertenecen al cristal como un todo.
, cristaliza en una estructura cúbica centrada en la cual cualquier átomo de Na es rodeado por ocho átomos vecinos. Por ello, los electrones de valencia no pueden estar localizados en un enlace entre un par concreto de átomos, en su lugar esos electrones están deslocalizados y pertenecen al cristal como un todo.
Teoría del la nube electrónica
Para explicar el enlace metálico se utiliza un modelo sencillo llamado del gas electrónico o de la nube electrónica. En este modelo el cristal de metal es considerado como una red tridimensional de cationes metálicos inmersos en un “mar” o “nube” de electrones deslocalizados que están libres para moverse a través del metal. Este continum de electrones deslocalizados, electrones de valencia móviles, actúan como un “pegamento” electrostático que mantiene los cationes metálicos juntos. Así, en este modelo, se supone que los electrones de valencia abandonan sus átomos (los metales tienen bajos potenciales de ionización), y forman una “nube” de electricidad negativa, colectiva y móvil, que se mueve libremente entre la malla que forma la red de los cationes resultantes, actuando a modo de “cemento” de unión entre ellos y evitando su repulsión eléctrica explosiva. Unos pocos electrones pueden así mantener unidos tantos átomos alrededor de uno cualquiera, puesto que tales electrones están deslocalizados y pueden ocupar un volumen mayor.
Este modelo permite explicar de una manera cualitativa sencilla la conductividad eléctrica y térmica de los metales. Debido a que los electrones son móviles, están libres para moverse desde un electrodo negativo hacia el electrodo positivo cuando un metal es sometido a un potencial eléctrico. Los electrones móviles pueden conducir también calor llevando la energía cinética de una parte del cristal metálico a otra. Los metales son maleables y dúctiles debido a que los enlaces deslocalizados se extienden en todas las direcciones, esto es no están confinados a unadirección del enlace, como en la red de sólidos igual que 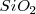 . Así cuando un cristal metálico es deformado, ningún enlace localizado es roto. En su lugar, los electrones de la nube ajustan su distribución de los cationes y la energía de la estructura deformada es similar a aquella original. Así la energía requerida para deformar un metal como el sodio es relativamente pequeña. La energía requerida para deformar un metal de transición igual que el hierro es más grande debido a que el hierro tiene más electrones de valencia y el “cemento” electrostático es más denso.
. Así cuando un cristal metálico es deformado, ningún enlace localizado es roto. En su lugar, los electrones de la nube ajustan su distribución de los cationes y la energía de la estructura deformada es similar a aquella original. Así la energía requerida para deformar un metal como el sodio es relativamente pequeña. La energía requerida para deformar un metal de transición igual que el hierro es más grande debido a que el hierro tiene más electrones de valencia y el “cemento” electrostático es más denso.
No obstante este modelo de gas o nube electrónica resulta insuficiente para explicar algunas de las propiedades de los metales. Aplicando los métodos de la mecánica cuántica se ha desarrollado una teoría más adecuada para explicar algunas propiedes el enlace metálico llamada, la de los Orbitales Moleculares deslocalizados, que ha recibido el nombre de Teoría de Bandas.
Tweet


