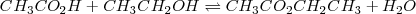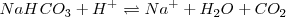Introducción al equilibrio químico
De Wikillerato
Chemaseg (Discutir | contribuciones)
(Página nueva: ==Introducción== Las ecuaciones para las reacciones químicas se escriben frecuentemente con una simple flecha que muestra la conversión de los productos en reactivos. Se asume que...)
Ir a las siguientes diferencias →
Revisión de 11:10 29 jun 2010
Introducción
Las ecuaciones para las reacciones químicas se escriben frecuentemente con una simple flecha que muestra la conversión de los productos en reactivos. Se asume que la reacción es completa y que al termino de la reacción no queda ningún reactivo habiéndose transformado todo en producto. No obstante muchas de las reacciones químicas no llegan a ser completas.
Por ejemplo, en la reacción de ácido acético con etanol la reacción procede hasta un cierto punto y se obtiene una mezcla de reactivos y de productos. Este sistema tiene reacciones directas e inversas que ocurren concurrentemente y que llegan a una posición de equilibrio
Para indicar que la reacción puede proceder en la dirección directa y la inversa, se escribe la ecuación balanceada con dos flechas, una apuntando de los reactivos a los productos y otra apuntando de los productos a los reactivos. En este contexto el término “producto” y “reactivo” podría ser confuso, debido a que los productos de la reacción directa son los reactivos de la reacción reversa. Para evitar confusiones se denominan por convención reactivos a las substancias del lado izquierdo de la ecuación química y el término productos a las substancias del lado derecho de la ecuación.
El equilibrio es denotado por el signo  en lugar de una única flecha. Todas las reacciones pueden se consideradas como equilibrios, pero en algunos casos la dirección directa es la dominante de tal manera que la dirección reversa puede ser ignorada. Así en sentido estricto, todas las reacciones químicas son reversibles. Las llamadas reacciones irreversibles son simplemente aquellas que proceden casi a la total completitud así que la mezcla de equilibrio contiene productos y casi ningún reactivo. Para estas reacciones, la reacción inversa es frecuentemente demasiado lenta para ser detectada.
en lugar de una única flecha. Todas las reacciones pueden se consideradas como equilibrios, pero en algunos casos la dirección directa es la dominante de tal manera que la dirección reversa puede ser ignorada. Así en sentido estricto, todas las reacciones químicas son reversibles. Las llamadas reacciones irreversibles son simplemente aquellas que proceden casi a la total completitud así que la mezcla de equilibrio contiene productos y casi ningún reactivo. Para estas reacciones, la reacción inversa es frecuentemente demasiado lenta para ser detectada.
Equilibrio Químico. Propiedades del equilibrio
El equilibrio químico corresponde a un estado dinámico que se alcanza cuando las concentraciones de los reactivos y de los productos permanecen constante con el tiempo
En un sistema químico se alcanza el equilibrio cuando tiene lugar la reacción en ambos sentidos a la misma velocidad, dando al sistema apariencia macroscópica de estabilidad, a pesar del hecho de que a nivel molecular, los reactivos se transforman en productos y viceversa. Esto es las tasas de reacción en dirección directa y reversa son iguales, y las concentraciones de los reactivos y de los productos permanecen constantes con el tiempo Así el equilibrio químico es un estado dinámico en el cual las reacciones directas e inversas continúan a una misma tasa así que no hay una conversión de reactivos en productos.
Cuando un sistema alcanza el equilibrio no puede cambiar más sin modificar las condiciones del sistema. Por tanto, el estado de equilibrio representa el grado máximo de progresión de una reacción, tanto en el sentido directo como en el inverso.
Ejemplo:
Pongamos vinagre (ácido acético) en un frasco, echamos bicarbonato de sodio y lo tapamos con un globo. Se produce una reacción química que despende dióxido de carbono ( )
)
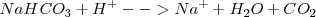
El 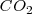 comienza a hinchar el globo hasta que ya no se hincha más, se ha alcanzado un equilibrio dinámico, parte del bicarbonato se convierte en
comienza a hinchar el globo hasta que ya no se hincha más, se ha alcanzado un equilibrio dinámico, parte del bicarbonato se convierte en 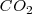 y simultáneamente, parte de este
y simultáneamente, parte de este 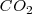 presionado por el globo se transforma en bicarbonato. Como el proceso se puede invertir decimos que el proceso es reversible. Por ello se escribe la ecuación en la forma
presionado por el globo se transforma en bicarbonato. Como el proceso se puede invertir decimos que el proceso es reversible. Por ello se escribe la ecuación en la forma
Si el sistema hubiera estado abierto, sin estar encerrado el 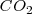 por el globo, el proceso hubiera sido irreversible, pues no habría forma de recuperar el dióxido de carbono e invertir la reacción.
por el globo, el proceso hubiera sido irreversible, pues no habría forma de recuperar el dióxido de carbono e invertir la reacción.
Todos los posibles casos de equilibrio se pueden agrupar en dos clases: equilibrios moleculares y equilibrios iónicos. Tanto los unos como los otros pueden tener lugar en sistemas homogéneos (equilibrios homogéneos) o sistemas heterogéneos (equilibrios heterogéneos).
Tweet