Principio de Le Chatelier
De Wikillerato
Tabla de contenidos |
Principio de Le Chatelier
El principio de Le Châtelier o ley general del desplazamiento del equilibrio químico, es un principio que permite predecir de forma cualitativa la influencia de la modificación de un factor cuando el sistema alcanza el equilibrio. Su nombre se debe a químico francés Henry Louis Le Chatelier (1850-1936) y dice así:
Si las condiciones de un sistema inicialmente en equilibrio son modificadas, el equilibrio cambiará en la dirección en la que se tienda a restaurar las condiciones originales de equilibrio, si tal cambio es posible.
O dicho de otros modos:
Cuando un cambio externo es realizado sobre un sistema en equilibrio, el sistema responde en una manera que se opone al cambio.
Si un "estrés" es aplicado a una mezcla de reacción en equilibrio, la reacción neta ocurre en la dirección que reduce el estrés
Esto es, cuando se perturba desde el exterior un sistema en equilibrio, este evoluciona de forma que se restablezca de nuevo el equilibrio, es decir, tendiendo a reducir el efecto ocasionado.
La palabra estrés en este contexto significa un cambio en la concentración, presión, volumen o temperatura que perturba el equilibrio original.
Cuando un sistema se encuentra en equilibrio, su estado viene determinado por el valor de la constante de equilibrio 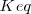 a una temperatura determinada. Si modificamos las condiciones en las que se encuentra el sistema variando las concentraciones de las especies, la presión, la temperatura, etc…, cambian las concentraciones, y con ello el cociente de reacción Q. En este caso, el sistema evoluciona de forma espontánea para hacer que Q se iguale a la constante de equilibrio
a una temperatura determinada. Si modificamos las condiciones en las que se encuentra el sistema variando las concentraciones de las especies, la presión, la temperatura, etc…, cambian las concentraciones, y con ello el cociente de reacción Q. En este caso, el sistema evoluciona de forma espontánea para hacer que Q se iguale a la constante de equilibrio 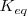
Ejemplo:
Consideremos la reacción del ión dicromato con el ión hidróxido:
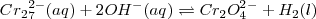
En la reacción con 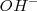 , el dicromato (
, el dicromato ( 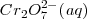 ) naranja es convertido en ión cromato
) naranja es convertido en ión cromato 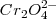 , pero en presencia de ácidos,
El cromato
, pero en presencia de ácidos,
El cromato 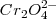 es convertido a dicromato
es convertido a dicromato 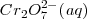 . Así alterando las concentraciones de alcali o de ácido, el equilibrio puede ser cambiado hacia la izquierda a derecha de la reacción.
. Así alterando las concentraciones de alcali o de ácido, el equilibrio puede ser cambiado hacia la izquierda a derecha de la reacción.
Esto es un ejemplo del principio de Le Chatelier el cual dice que cunado un cambio externo es realizado sobre un sistema en equilibrio, el sistema responde para oponerse al cambio.
Influencia de cambios de la concentración de reactivos o productos
En una reacción química expresada de forma general:

La ley de acción de masas o ley del equilibrio se expresa como:
![\frac{ [C]^{c} [D]^{d} }{[A]^{a} [B]^{b}}= K_c \frac{ [C]^{c} [D]^{d} }{[A]^{a} [B]^{b}}= K_c](/images/math/math-84a2e7be66dab7480344be6d8c19681a.png)
Donde 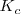 es la constante de equilibrio. Donde el suindice nos dice que tratamos con concentraciones molares de las sustancias. El valor de la constante de equilibrio
es la constante de equilibrio. Donde el suindice nos dice que tratamos con concentraciones molares de las sustancias. El valor de la constante de equilibrio 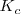 solo se ve influenciada por la temperatura que transcurre la reacción.
solo se ve influenciada por la temperatura que transcurre la reacción.
En general 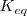 . Por ello cualquier variación de la concentración en algunas sustancias supondrá una variación en las demás a fin de mantener constante
. Por ello cualquier variación de la concentración en algunas sustancias supondrá una variación en las demás a fin de mantener constante 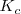
En general, cuando el equilibrio es perturbado por la adicción o retirada de cualquier reactivo o cualquier producto, el principio de Le Châtelier predice que:
Si se aumenta la concentración de uno de los productos de reacción, el sistema para contrarrestarlo, evoluciona hacia la izquierda de la reacción, de tal manera que la reacción neta consume la sustancia añadida. Así, si aumentamos la concentración de algún reactivo, el sistema, para compensarlo, se desplazará hacia la derecha, disminuyendo la concentración de los reactivos y aumentando la de los productos. El estrés en la concentración que se realiza al añadir un reactivo o un producto a un sistema en equilibrio es contrarestado por una reacción neta en la dirección que consume la sustancia añadida.
Si se elimina alguna sustancia el sistema evolucionará hacia ese lado para producir más cantidad de dicha sustancia y restablecer el equilibrio. Así si el estrés de concentración es originado por la eliminación de un reactivo o un producto, este es contrarestado por la reacción neta en la dirección que produce reponiendo el producto eliminado.
La variación de las concentraciones de las sustancias que no interviene en la expresión de la constante de equilibrio no modifica el equilibrio.
Ejemplo:
En la producción industrial de amoniaco siguiendo el proceso Haber, estas reglas pueden ser aplicadas al equilibrio
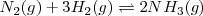
La producción de amoniaco es aumentada por un incremento en la concentración de 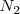 o la concentración de
o la concentración de 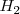 o por un descenso en la concentración de amoniaco. En el proceso industrial de producción de amoniaco, la concentración gaseosa de
o por un descenso en la concentración de amoniaco. En el proceso industrial de producción de amoniaco, la concentración gaseosa de 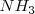 es reducida licuando el amoniaco (bp -33ºC) y así más amoniaco es producido.
es reducida licuando el amoniaco (bp -33ºC) y así más amoniaco es producido.
Ejemplo:
Otro ejemplo de cómo el cambio en la concentración afecta al equilibrio consideremos la reacción en solución acuosa (aq) del hierro (III) ( de color amarillo) y del ión tiocianato (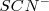 (sin color) para dar una mezcla en equilibrio que contiene Fe-N unido al complejo iónico rojo
(sin color) para dar una mezcla en equilibrio que contiene Fe-N unido al complejo iónico rojo 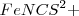 (de color rojo):
(de color rojo):
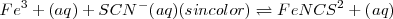
El cambio en la posición de este equilibrio puede ser detectado observando como el color de la solución cambia cuando se añaden varios reactivos.
Si se añade 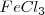 , el color rojo es más oscuro, tal como predice el principio de Le Châtelier. Esto es el incremento en la concentración de ión
, el color rojo es más oscuro, tal como predice el principio de Le Châtelier. Esto es el incremento en la concentración de ión 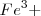 que se produce al añadir el
que se produce al añadir el 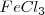 es contrarrestado por la reacción neta en el sentido de derecha a izquierda que consume algo del ión
es contrarrestado por la reacción neta en el sentido de derecha a izquierda que consume algo del ión 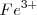 añadido para producir
añadido para producir 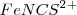 que aumenta la concentración aumentando con ello la rojez de la solución (los iones
que aumenta la concentración aumentando con ello la rojez de la solución (los iones 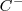 no participan en la reacción). De igual manera si se añade a la solución acuosa
no participan en la reacción). De igual manera si se añade a la solución acuosa 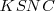 , el “estrés” de añadir iones
, el “estrés” de añadir iones 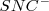 cambia el equilibrio de la izquierda a la derecha y de nuevo el color aparece de la solución más rojo.
cambia el equilibrio de la izquierda a la derecha y de nuevo el color aparece de la solución más rojo.
El equilibrio puede ser cambiado en la dirección opuesta (de izquierda a derecha) añadiendo reactivos que eliminan iones 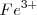 o iones
o iones 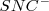 . Por ejemplo, ácido oxálico (
. Por ejemplo, ácido oxálico (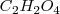 ) el cula reacciona con los iones
) el cula reacciona con los iones 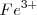 para formar un complejo estable iónico
para formar un complejo estable iónico 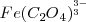 , disminuyendo con ello la concentración de
, disminuyendo con ello la concentración de 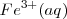 libre. De acuerdo con el pricipio de Le Châtelier , el “estrés en la concentración” de eliminar iones libres
libre. De acuerdo con el pricipio de Le Châtelier , el “estrés en la concentración” de eliminar iones libres 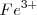 de la solución es restaurado por la disociación de
de la solución es restaurado por la disociación de 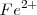 para reponer iones
para reponer iones 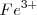 en la solución. Debido a que la concentración de
en la solución. Debido a que la concentración de 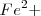 disminuye, la intensidad del color rojo de la solución disminuye.
disminuye, la intensidad del color rojo de la solución disminuye.
Cuando se añade 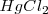 también elimina el color rojo debido a que los iones
también elimina el color rojo debido a que los iones 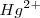 reaccionan con lo iones
reaccionan con lo iones 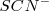 para formar el complejo iónico estable
para formar el complejo iónico estable 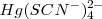 . La eliminación de iones libres
. La eliminación de iones libres 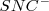 cambia el equilibrio:
cambia el equilibrio:

De la derecha a la izquierda para reponer los iones 
Influencia de variaciones de la presión y el volumen
El efecto de la presión sobre el equilibrio solo se aprecia si alguna o todas las sustancias que interviene en la reacción están en fase gaseosa. Cuantitativamente, la influencia de la presión se basa en las ecuaciones que definen las constantes de equilibrio y sus relaciones:
Para una reacción general:

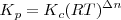
Donde 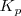 es la constnte de equilibrio definda utilizando presiones parciales (el subíndice p nos recuerda este hecho);
es la constnte de equilibrio definda utilizando presiones parciales (el subíndice p nos recuerda este hecho); 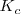 es la cosntante de equilibrio expresada en concentraciones molares;
es la cosntante de equilibrio expresada en concentraciones molares; 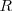 es la constante de los gases
es la constante de los gases 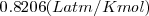 ; T es la temperatura absoluta en grados Kelvin y
; T es la temperatura absoluta en grados Kelvin y 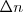 es el número de moles de los productos gaseosos menos el número de moles de los rectivos gaseosos.
es el número de moles de los productos gaseosos menos el número de moles de los rectivos gaseosos.
Si se modifica la presión parcial de alguna sustancia en el estado de equilibrio, se modifican los valores de las presiones parciales de las demás sustancias con el fin de que 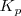 permanezca constante, lo que obliga también a que se modifiquen las concentraciones
permanezca constante, lo que obliga también a que se modifiquen las concentraciones
Si varia la presión total, el sistema evoluciona espontáneamente en el sentido de disminuir el efecto producido, originándose sustancias que ocupen menor volumen, sentido que conduce a la formación de un número menor de moles si la presión aumenta. Y formando sustancias que ocupen más volumen, sentido que conduce a un número de moles mayor si la presión disminuye.
Una variación de presión supone una variación contraria del volumen, de manera que si aumenta el volumen, el equilibrio se desplaza en el mismo sentido que lo haría con una disminución de presión, y si se disminuye el volumen, el equilibrio se desplaza en el mismo sentido que lo haría se aumenta la presión. Pero si se modifica el volumen, manteniendo constante la presión, el equilibrio no se afecta.
Si aumenta la presión externa sobre el sistema, disminuye su volumen. El sistema evoluciona para compensar ese efecto, hacia el lado que haya menos moles, de forma que disminuya la presión. Si disminuimos la presión externa, aumenta el volumen; el sistema se desplazará hacia el lado en el que haya mayor número de moles; de esta manera, aumenta el volumen, con lo que se incrementa de nuevo la presión
Así en general el principio de Le Châtelier predice que:
-Un incremento en la presión que reduce el volumen producirá una reacción neta en la dirección que disminuye el número de moles del gas. -Una disminución en la presión que se produce por un incremento en el volumen producirá una reacción neta en la dirección que incrementa el número de moles del gas.
Influencia de la temperatura de reacción
También de forma cualitativa, según el principio de Le Châtelier puede deducirse la influencia de la temperatura en el equilibrio de la reacción. Si aumentamos la temperatura de un sistema, para contrarrestar el aumento, se desplaza en el sentido en que la reacción sea endotérmica. De esta manera se consume parte del calor y disminuye la temperatura. Es decir, en una reacción endotérmica, al aumentar la temperatura, el equilibrio se desplazará hacia la derecha. Si disminuimos la tempesratura, el sistema evoluciona en el sentido en que la reacción sea exotérmica, al disminuir la temperatura, el equilibrio se desplaza hacia laderecha.
En este caso sólo podemos utiloizar el cociente de reacción Q para averiguar lo que ocurre si conocemos el valor de la constante a la nueva constante de equilibrio. Es la situación en la que mayor utilidad ofrece el principio de Le Châtelier
En general, la dependencia de la constante de equilibrio con la temperatura depende del signo de la entalpía estándar de la reacción  :
:
.- La constante de equilibrio de una reacción exotérmica ((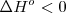 ) disminuye cundo la temperatura se incrementa.
) disminuye cundo la temperatura se incrementa.
.- La constante de equilibrio para una reacción endotérmica (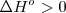 ) se incrementa cuando la temperatura se incrementa
) se incrementa cuando la temperatura se incrementa
Por ejemplo:
La reacción endotérmica de descomposición del 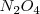
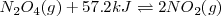

El principio de Le Châtelier dice que si añadimos calor a la mezcla de equilibrio (así incrementando su temperatura), la reacción neta ocurre en la dirección que alivia el estrés del calor añadido. Para una reacción endotérmica, tales como la descomposición de 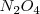 el calor es absorbido por la reacción en sentido directo. Por lo tanto el equilibrio se desplaza hacia la derecha en alta temperatura, lo cual significa que la constante de equilibrio se incrementa la incrementar la temperatura.
el calor es absorbido por la reacción en sentido directo. Por lo tanto el equilibrio se desplaza hacia la derecha en alta temperatura, lo cual significa que la constante de equilibrio se incrementa la incrementar la temperatura.



