Teoría de Bandas de Energía
De Wikillerato
(Página nueva: ==Teoría de Bandas de Energía== La Teoría de Bandas de Energía es una teoría explicativa del enlace metálico desarrollada a partir de métodos de la Mecánica Cuántica. Una ba...) |
|||
| (2 ediciones intermedias no se muestran.) | |||
| Línea 1: | Línea 1: | ||
| - | + | La Teoría de Bandas de Energía es una teoría explicativa que proporciona una mejor comprensión del enlace metálico desarrollada a partir de métodos de la [[Mecánica Cuántica]] (MC) basada en la teoría de los orbitales moleculares deslocalizados. Es usada para explicar el lustro característico de los metales, su buena conductividad eléctrica y térmica y su maleabilidad. | |
| - | + | Una banda consiste de un número contable pero cercano a un ''continum'' de niveles de energía | |
| - | + | Una banda de energía se origina cuando <math> n </math>[[orbitales atómicos]] (OA) correspondientes a <math>n átomos, interaccionan para dar lugar por combinación lineal a n [[orbitales moleculares]] (OM) cuyas energía están muy próximas. Un orbital molecular es una [[función de onda]] cuyo cuadrado indica la probabilidad de encontrar un electrón dentro de una región del espacio dado dentro de una molécula. Al igual que un orbital atómico los OM tienen niveles de energía específicos y pueden ser ocupados por un máximo de dos electrones con signo opuestos del espín. | |
| + | Así un orbital molecular es a una molécula lo que un orbital atómico es a un átomo. | ||
| + | |||
| + | El solapamiento de un gran número de orbitales atómicos conduce a orbitales moleculares que tienen energías muy próximas entres si formando una banda continua que cubre un amplio rango de energías. En un diagrama de energía las bandas están separadas por '''brechas''' (''gap'' en inglés) los cuales son valores de energía en los que no hay orbitales. | ||
| + | Si la banda está construida con orbitales <math< s </math> se denomina '''banda s''', si los orbitales p están disponibles una banda p puede ser construida a partir del solapamiento entre ellos. Debido a que los orbitales p están más altos energéticamente que los orbitales s hay frecuentemente una brecha energética entre las bandas s y la banda p. No obstante, si las bandas abarcan un amplio rango de energía y las energía de los orbitales <math>s </math> y <math>p </math> son similares entonces las dos bandas solapan. La banda <math>d </math> es de igual manera construida por el solapamiento de orbitales <math> d </math>. | ||
| + | Para entender como se forma una banda podemos considerar una línea de átomos, y suponer que cada átomo tiene un orbital atómico <math> s </math> que solapa con el orbital <math> s </math> más cercano. Cuando la línea está formada solo por átomos se forma un [[orbital sigma]] <math> \sigma </math> enlazante (llamado así debido a que los electrones que contiene pasan la mayor parte de su tiempo en la región entre los dos núcleos, contribuyendo con ello a mantener enlazados los átomos) que tiene menor energía que los dos orbitales atómicos sigma y otro [[orbital antilenlazante]]; <math> \sigma^* </math> (debido a que cualquier electrón que contenga no puede ocupar la región central entre los núcleos atómicos y no pueden contribuir con ello al enlace de los átomos en la molécula teniendo por ello un nodo entre los núcleos) que tiene más energía. Cuando un tercer átomo es añadido hay tres orbitales. Cuanto más átomos son añadidos, cada uno contribuye con un orbital atómico y por lo tanto más OM son formados. Así cuando hay <math<n </math> átomos en línea, hay <math>n </math> orbitales moleculares. El orbital de energía más bajo no tiene nodos entre los átomos más cercanos. Mientras que los orbitales de más energía tiene un nodo entre cada par de átomos cercanos. Los restantes orbitales tiene sucesivamente <math> 1,2,3… </math> nodos internucleares y el correspondiente rango de energías entre los dos extremos. El ancho de banda permanece finito aun cuando el número n de átomos se aproxime al infinito. Y depende de la fuerza de la interacción entre los átomo cercanos. | ||
| + | |||
| + | Las bandas de energía pueden estar totalmente llenas, si el número de electrones de valencia es <math> 2n </math>, siendo <math> n </math> el número de orbitales de la banda; estar parcialmente ocupada, si el número de electrones es menor de <math> 2n </math>; o vacía cuando la banda procede de orbitales atómicos no ocupados en el estado fundamental del átomo. Todo ello debido a que se cumple el [[Principio de Exclusión de Pauli]], por el que cada nivel puede estar ocupado por dos electrones de espín contrario, y a que los orbitales de las bandas son siempre discretos, si bien muy próximos. Existe superposición de bandas correspondientes a diferentes orbitales atómicos. Como ocurre frecuentemente en los metales. | ||
| + | Por ejemplo en el caso del litio, tiene estructura electrónica es <math>1s^2 2s^1 </math>, supongamos que se forma un cristal macroscópico del orden del <math>10^{20} </math> átomos. Su agregación mutua habrá generado una banda de energía de <math> 10^{20} </math> orbitales moleculares (OM), a partir de los <math>10^{20} </math> orbitales atómicos del tipo <math>2s^1 </math>, puesto que los orbitales <math> 1s </math> están llenos y darían lugar por lo tanto a otros OM llenos, que contribuirían poco al enlace de los átomos de litio. | ||
| - | + | La banda de energía parcialmente llena alcanza al cristal metálico en su conjunto. Como cada OM puede alogar dos electrones (con espines opuestos), en la banda caben <math> 2 x 10^{20} </math> electrones, pero sólo se dispone de <math>10^{20} </math> electrones que provienen de los <math> 10^{20} </math> orbitales moleculares <math> 2s </math>, lo que da lugar a una banda de energía semivacía. Es la '''banda de valencia''', formada por los electrones de valencia de los átomos. | |
| + | Además como cada átomo tiene tres orbitales atómicos <math> 2p </math> vacíos se genera se genera otra banda de energía vacía con <math> 3 x10^{20} </math> OM. Esta es la '''banda de conducción''', que se superpone en parte con la energía más altas de la banda de valencia para formar un espectro continuo de energías. Esta superposición de las bandas de de mayor energía es la situación que se da en la mayoría de los metales. | ||
| + | |||
| + | Por otra parte los OA <math> 1s </math> del litio (con dos electrones cada uno) dan lugar a una banda totalmente ocupada. | ||
| + | |||
| + | La brecha de energía entre la banda parcialmente llena y la banda totalmente ocupada es muy grande, lo que impide con efectividad la promoción de electrones de una banda a otra más alta. A estas brechas se las ha dado llamar '''zonas de energía prohibidas'''. En el diamante esta brecha energética es muy alta de 520 kJ/mol | ||
| + | |||
| + | Si la banda de conducción no se superpone con la de valencia, los electrones no pueden tener valores de energía en esas zonas. Cuando estas zonas prohibidas presentan una variación pequeña de energía en el nivel más alto de la banda de valencia y el más bajo en la de conducción, se trata de una situación propia de los '''semiconductores'''. Un semiconductor como su nombre indica es un material que riene una conductividad eléctrica intermedia entre un conductor y un aislante. Cuando este incremento de energía es muy elevado, tenemos el caso de los '''aisladores o aislantes'''. | ||
| + | |||
| + | Así, un conducto metálico tiene bandas semivacias, un aislante tiene la banda de valencia totalmente llena con una banda de conducción totalmente vacía, que están separadas por un gran gap de energía. En los semiconductores este gap es más pequeño, por lo que unos pocos electrones tendrán suficiente energía para saltar el gap y ocupar los niveles más altos de la banda de conducción por lo que la banda de conducción está parcialmente ocupada con unos pocos electros y una banda de valencia parcialmente vacía debido a que ahora tiene unos pocos OM no ocupados. | ||
| + | |||
| + | Los electrones de valencia en un metal tienen a su disposición, mediante incrementos infinitesimales de energía, todo el tramo de estados energéticos, que incluye media banda de OM de valencia y la banda entera de conducción, por lo que la libertad de movimientos en el seno del cristal metálico es muy grande, Esto explica la buena conductividad de los metales. | ||
| + | |||
| + | ==Redes cristalinas metálicas== | ||
[[Categoría: Química]] | [[Categoría: Química]] | ||
Revisión actual
La Teoría de Bandas de Energía es una teoría explicativa que proporciona una mejor comprensión del enlace metálico desarrollada a partir de métodos de la Mecánica Cuántica (MC) basada en la teoría de los orbitales moleculares deslocalizados. Es usada para explicar el lustro característico de los metales, su buena conductividad eléctrica y térmica y su maleabilidad.
Una banda consiste de un número contable pero cercano a un continum de niveles de energía
Una banda de energía se origina cuando  orbitales atómicos (OA) correspondientes a [Unparseable or potentially dangerous latex formula. Error 1 ] se denomina banda s, si los orbitales p están disponibles una banda p puede ser construida a partir del solapamiento entre ellos. Debido a que los orbitales p están más altos energéticamente que los orbitales s hay frecuentemente una brecha energética entre las bandas s y la banda p. No obstante, si las bandas abarcan un amplio rango de energía y las energía de los orbitales
orbitales atómicos (OA) correspondientes a [Unparseable or potentially dangerous latex formula. Error 1 ] se denomina banda s, si los orbitales p están disponibles una banda p puede ser construida a partir del solapamiento entre ellos. Debido a que los orbitales p están más altos energéticamente que los orbitales s hay frecuentemente una brecha energética entre las bandas s y la banda p. No obstante, si las bandas abarcan un amplio rango de energía y las energía de los orbitales  y
y 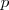 son similares entonces las dos bandas solapan. La banda
son similares entonces las dos bandas solapan. La banda 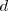 es de igual manera construida por el solapamiento de orbitales
es de igual manera construida por el solapamiento de orbitales 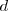 .
.
Para entender como se forma una banda podemos considerar una línea de átomos, y suponer que cada átomo tiene un orbital atómico  que solapa con el orbital
que solapa con el orbital  más cercano. Cuando la línea está formada solo por átomos se forma un orbital sigma
más cercano. Cuando la línea está formada solo por átomos se forma un orbital sigma  enlazante (llamado así debido a que los electrones que contiene pasan la mayor parte de su tiempo en la región entre los dos núcleos, contribuyendo con ello a mantener enlazados los átomos) que tiene menor energía que los dos orbitales atómicos sigma y otro orbital antilenlazante;
enlazante (llamado así debido a que los electrones que contiene pasan la mayor parte de su tiempo en la región entre los dos núcleos, contribuyendo con ello a mantener enlazados los átomos) que tiene menor energía que los dos orbitales atómicos sigma y otro orbital antilenlazante; 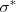 (debido a que cualquier electrón que contenga no puede ocupar la región central entre los núcleos atómicos y no pueden contribuir con ello al enlace de los átomos en la molécula teniendo por ello un nodo entre los núcleos) que tiene más energía. Cuando un tercer átomo es añadido hay tres orbitales. Cuanto más átomos son añadidos, cada uno contribuye con un orbital atómico y por lo tanto más OM son formados. Así cuando hay <math<n </math> átomos en línea, hay
(debido a que cualquier electrón que contenga no puede ocupar la región central entre los núcleos atómicos y no pueden contribuir con ello al enlace de los átomos en la molécula teniendo por ello un nodo entre los núcleos) que tiene más energía. Cuando un tercer átomo es añadido hay tres orbitales. Cuanto más átomos son añadidos, cada uno contribuye con un orbital atómico y por lo tanto más OM son formados. Así cuando hay <math<n </math> átomos en línea, hay  orbitales moleculares. El orbital de energía más bajo no tiene nodos entre los átomos más cercanos. Mientras que los orbitales de más energía tiene un nodo entre cada par de átomos cercanos. Los restantes orbitales tiene sucesivamente
orbitales moleculares. El orbital de energía más bajo no tiene nodos entre los átomos más cercanos. Mientras que los orbitales de más energía tiene un nodo entre cada par de átomos cercanos. Los restantes orbitales tiene sucesivamente 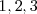 nodos internucleares y el correspondiente rango de energías entre los dos extremos. El ancho de banda permanece finito aun cuando el número n de átomos se aproxime al infinito. Y depende de la fuerza de la interacción entre los átomo cercanos.
nodos internucleares y el correspondiente rango de energías entre los dos extremos. El ancho de banda permanece finito aun cuando el número n de átomos se aproxime al infinito. Y depende de la fuerza de la interacción entre los átomo cercanos.
Las bandas de energía pueden estar totalmente llenas, si el número de electrones de valencia es 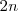 , siendo
, siendo  el número de orbitales de la banda; estar parcialmente ocupada, si el número de electrones es menor de
el número de orbitales de la banda; estar parcialmente ocupada, si el número de electrones es menor de 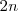 ; o vacía cuando la banda procede de orbitales atómicos no ocupados en el estado fundamental del átomo. Todo ello debido a que se cumple el Principio de Exclusión de Pauli, por el que cada nivel puede estar ocupado por dos electrones de espín contrario, y a que los orbitales de las bandas son siempre discretos, si bien muy próximos. Existe superposición de bandas correspondientes a diferentes orbitales atómicos. Como ocurre frecuentemente en los metales.
; o vacía cuando la banda procede de orbitales atómicos no ocupados en el estado fundamental del átomo. Todo ello debido a que se cumple el Principio de Exclusión de Pauli, por el que cada nivel puede estar ocupado por dos electrones de espín contrario, y a que los orbitales de las bandas son siempre discretos, si bien muy próximos. Existe superposición de bandas correspondientes a diferentes orbitales atómicos. Como ocurre frecuentemente en los metales.
Por ejemplo en el caso del litio, tiene estructura electrónica es 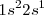 , supongamos que se forma un cristal macroscópico del orden del
, supongamos que se forma un cristal macroscópico del orden del 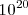 átomos. Su agregación mutua habrá generado una banda de energía de
átomos. Su agregación mutua habrá generado una banda de energía de 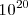 orbitales moleculares (OM), a partir de los
orbitales moleculares (OM), a partir de los 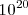 orbitales atómicos del tipo
orbitales atómicos del tipo 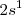 , puesto que los orbitales
, puesto que los orbitales 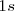 están llenos y darían lugar por lo tanto a otros OM llenos, que contribuirían poco al enlace de los átomos de litio.
están llenos y darían lugar por lo tanto a otros OM llenos, que contribuirían poco al enlace de los átomos de litio.
La banda de energía parcialmente llena alcanza al cristal metálico en su conjunto. Como cada OM puede alogar dos electrones (con espines opuestos), en la banda caben 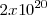 electrones, pero sólo se dispone de
electrones, pero sólo se dispone de 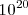 electrones que provienen de los
electrones que provienen de los 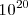 orbitales moleculares
orbitales moleculares 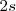 , lo que da lugar a una banda de energía semivacía. Es la banda de valencia, formada por los electrones de valencia de los átomos.
, lo que da lugar a una banda de energía semivacía. Es la banda de valencia, formada por los electrones de valencia de los átomos.
Además como cada átomo tiene tres orbitales atómicos 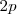 vacíos se genera se genera otra banda de energía vacía con
vacíos se genera se genera otra banda de energía vacía con 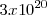 OM. Esta es la banda de conducción, que se superpone en parte con la energía más altas de la banda de valencia para formar un espectro continuo de energías. Esta superposición de las bandas de de mayor energía es la situación que se da en la mayoría de los metales.
OM. Esta es la banda de conducción, que se superpone en parte con la energía más altas de la banda de valencia para formar un espectro continuo de energías. Esta superposición de las bandas de de mayor energía es la situación que se da en la mayoría de los metales.
Por otra parte los OA 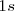 del litio (con dos electrones cada uno) dan lugar a una banda totalmente ocupada.
del litio (con dos electrones cada uno) dan lugar a una banda totalmente ocupada.
La brecha de energía entre la banda parcialmente llena y la banda totalmente ocupada es muy grande, lo que impide con efectividad la promoción de electrones de una banda a otra más alta. A estas brechas se las ha dado llamar zonas de energía prohibidas. En el diamante esta brecha energética es muy alta de 520 kJ/mol
Si la banda de conducción no se superpone con la de valencia, los electrones no pueden tener valores de energía en esas zonas. Cuando estas zonas prohibidas presentan una variación pequeña de energía en el nivel más alto de la banda de valencia y el más bajo en la de conducción, se trata de una situación propia de los semiconductores. Un semiconductor como su nombre indica es un material que riene una conductividad eléctrica intermedia entre un conductor y un aislante. Cuando este incremento de energía es muy elevado, tenemos el caso de los aisladores o aislantes.
Así, un conducto metálico tiene bandas semivacias, un aislante tiene la banda de valencia totalmente llena con una banda de conducción totalmente vacía, que están separadas por un gran gap de energía. En los semiconductores este gap es más pequeño, por lo que unos pocos electrones tendrán suficiente energía para saltar el gap y ocupar los niveles más altos de la banda de conducción por lo que la banda de conducción está parcialmente ocupada con unos pocos electros y una banda de valencia parcialmente vacía debido a que ahora tiene unos pocos OM no ocupados.
Los electrones de valencia en un metal tienen a su disposición, mediante incrementos infinitesimales de energía, todo el tramo de estados energéticos, que incluye media banda de OM de valencia y la banda entera de conducción, por lo que la libertad de movimientos en el seno del cristal metálico es muy grande, Esto explica la buena conductividad de los metales.



