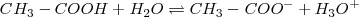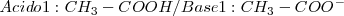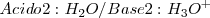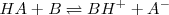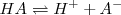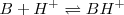Teoría de Lowry y Brönsted. Par ácido-base conjugado
De Wikillerato
Teoría de Lowry y Brönsted. Par ácido-base conjugado
En 1923 el químico danés Johannes Niclaus Brönsted (1879-1947) y el químico inglés Thomas Martin Lowry (1874-1936) propusieron de forma independiente y simultánea un definición de ácidos y base más amplia que la propuesta por el químico sueco Svante August Arrhenius (1859-1927), aplicable incluso a los disolventes no acuosos:
Según Brönsted-Lowry:
Ácido es una sustancia química (molécula o ión) capaz de ceder un protón a otra .i.e transferir un protón (ión) a otra sustancia.
Base es una especie química capaz de aceptar un protón procedente de otra.
Así de manera simplificada según la teoría de Brönsted-Lowry, los ácidos son pues donadores de protones y las bases aceptores de protones, y una reacción ácido-base es un proceso de transferencia de protones.
Donde:
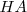 actúa como donador de protones (ácido)
actúa como donador de protones (ácido) 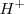 , y
, y 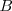 actúa como base al aceptar protones. Pero las especies químicas
actúa como base al aceptar protones. Pero las especies químicas 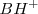 y
y 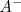 son así mismos ácidos y bases. Así la especia
son así mismos ácidos y bases. Así la especia 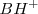 producida cuando la base
producida cuando la base 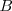 acepta un protón de la especie
acepta un protón de la especie 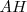 puede así mismo donar un protón a la especie <math< A^- </math> indicando con ello que es un ácido Brönsted-Lowry. De igual manera la especie
puede así mismo donar un protón a la especie <math< A^- </math> indicando con ello que es un ácido Brönsted-Lowry. De igual manera la especie 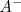 producida cuando la especie
producida cuando la especie 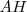 pierde un protón puede por si misma aceptar de nuevo de la especie
pierde un protón puede por si misma aceptar de nuevo de la especie 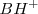 , significando que ahora es una base Brönsted-Lowry.
, significando que ahora es una base Brönsted-Lowry.
Especies químicas cuyas formulas difieren solo por un protón se dice que son pares ácido-base conjugados. Así 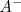 es la base conjugada del ácido
es la base conjugada del ácido 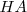 , mientras que
, mientras que 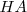 es el ácido conjugado de la base
es el ácido conjugado de la base 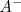 .
.
De igual manera 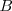 es la base conjugada del ácido
es la base conjugada del ácido 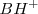 y
y 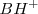 es el ácido conjugado de la base
es el ácido conjugado de la base 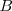 .
.
Por lo tanto, podemos considerar la existencia de dos pares ácido-base conjugados:
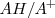 y
y 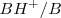
Entre otros muchos fenómenos químicos esta teoría puede explicar la basicidad del amoniaco 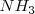 o el carbonato cálcio
o el carbonato cálcio 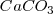 al entrar en contacto con el agua, explicación que no podía ofrecer la teoría de ácidos y bases de Arrhenius.
al entrar en contacto con el agua, explicación que no podía ofrecer la teoría de ácidos y bases de Arrhenius.
El amoniaco 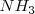 , al disolverse en agua
, al disolverse en agua 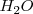 , le sustrae un protón a ésta, i.e. acepta un protón del solvente el cual actúa como un ácido, que se convierte en ión hidróxido (la base conjugada del agua), mientras que el amoniaco se convierte en ión amonio
, le sustrae un protón a ésta, i.e. acepta un protón del solvente el cual actúa como un ácido, que se convierte en ión hidróxido (la base conjugada del agua), mientras que el amoniaco se convierte en ión amonio 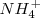 (el ácido conjugado de
(el ácido conjugado de 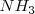 :
:
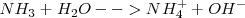
![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png)
Y el ión hidróxido producido 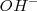 da el carácter básico a la disolución resultante.
da el carácter básico a la disolución resultante.
Los pares ácidos/base Brönsted-Lowry de esta reacción son 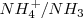 y
y 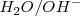
De igual manera ocurre con el ión carbonato:
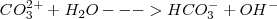
![[2] [2]](/images/math/math-d7758b02df617420addea66f693ef158.png)
En las reacciones [1] y [2] el agua 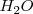 ha actuado como un ácido pues ha cedido un protón. Pero el agúa también puede funcionar como base, por ejemplo en la disolución del ácido clorhídrico
ha actuado como un ácido pues ha cedido un protón. Pero el agúa también puede funcionar como base, por ejemplo en la disolución del ácido clorhídrico
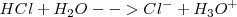
El ión 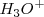 tiene el nombre sistemático de oxonio y en su forma solvatada (hidratada)
tiene el nombre sistemático de oxonio y en su forma solvatada (hidratada) 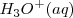 recibe el nombre de hidronio. En la práctica corriente se suele escribir en la primera forma y nombrarlo como hidronios. Incluso de manera simplificada en muchas ecuaciones se escribe como
recibe el nombre de hidronio. En la práctica corriente se suele escribir en la primera forma y nombrarlo como hidronios. Incluso de manera simplificada en muchas ecuaciones se escribe como 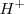
Las sustancias químicas que pueden actuar ya sea como base ya sea como ácido, recibe el nombre de anfiprótica. El la teoría de Arrhenius esas sustancias se denominaban anfóteras
Por ejemplo:
En la disolución del ácido acético en agua aparecen los siguientes pares conjugados