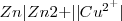Células galvánicas. Potencial de un electrodo. Electrodo de gases
De Wikillerato
Fuerza electromotriz de origen químico
En todas las reacciones de oxidación-reducción (abreviadamente reacciones redox) por ello fenómenos de transferencia de electrones se parte de la tendencia de los oxidantes a sustraer electrones de los reductores
En principio se puede aprovechar esta tendencia energética, esta fuerza, para crear una corriente eléctrica mediante un conductor que sirviera de canal a los electrones que son transferidos desde el reductor al oxidante. Con ello se habría creado un dispositivo que transformaría la energía química de una reacción redox en energía eléctrica, i.e. en realizar trabajo eléctrico.
Consideremos la siguiente sencilla reacción redox, la cual ocurre cunado el cinc metálico se pone en contacto con una disolución acuosa de iones cobre (II):
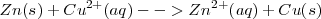
En esta reacción redox el 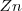 es oxidado (por perdida de dos electrones) a
es oxidado (por perdida de dos electrones) a 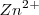 mientras que el
mientras que el 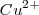 es reducido a Cu (por aceptación de dos electrones). La reacción es fácil de ensayar. En un vaso de precipitado se introduce una disolución de sulfato de cobre y después se sumerge en la misma una lámina de cinc. A medida que pasa el tiempo se observa que la disolución va perdiendo el color azulado propio de los iones cobre (II) solvatados, mientras que la lámina de cinc se va cubriendo de una capa rojiza formada por el cobre metálico que se va depositando.
es reducido a Cu (por aceptación de dos electrones). La reacción es fácil de ensayar. En un vaso de precipitado se introduce una disolución de sulfato de cobre y después se sumerge en la misma una lámina de cinc. A medida que pasa el tiempo se observa que la disolución va perdiendo el color azulado propio de los iones cobre (II) solvatados, mientras que la lámina de cinc se va cubriendo de una capa rojiza formada por el cobre metálico que se va depositando.
Para construir una pila que tenga como fundamento esta reacción, se necesita separar espacialmente los dos procesos:
Semireacción de oxidación: 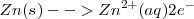
Semireacción de reducción: 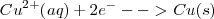
Disponiéndolos en compartimentos separados y utilizando un hilo conductor que lleve los electrones desde el reductor hasta el oxidante. Con esto casi se tendría construida una pila eléctrica.
Pila de Daniell
Una pila galvánica o también pila voltaica llamadas así en honor del científico italiano Luigi Galvani (1737-1798) y Alessandro Volta (1745-1827) quienes hicieron los primeros trabajos pioneros en electroquímica es :
Un dispositivo que convierte la energía libre de un proceso redox espontáneo en energía eléctrica
Una pila de Daniell es un ejemplo de pila galvánica que fue construida por primera vez en 1836 por el químico inglés John Frederick Daniell ( ). Esta basada en la reacción redox descrita anteriormente.
En la pila Daniell hay dos disoluciones, una de iones 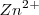 por ejemplo en forma de sulfato de cinc
por ejemplo en forma de sulfato de cinc 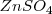 en contacto con una barra de este metal. Otra disolución de iones
en contacto con una barra de este metal. Otra disolución de iones 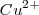 en forma de sulfato de cobre
en forma de sulfato de cobre 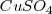 en contacto con una barra de cobre. Las disoluciones se encuentran separadas para evitar que los iones
en contacto con una barra de cobre. Las disoluciones se encuentran separadas para evitar que los iones 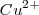 tomen directamente de la barra de cinc por los que tienen afinidad.
tomen directamente de la barra de cinc por los que tienen afinidad.
Las barras de metal de cobre y cinc reciben el nombre de electrodos, y están conectados por un hilo conductor. Además las dos disoluciones están conectadas por un puente salino (en forma de U) que contiene un gel permeable con un electrolito inerte tal como sulfato de sodio 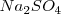 . Los iones de este electrolito inerte no reaccionan con los otros iones de las disoluciones, y no son ni reducidos ni oxidados en los electrodos.
. Los iones de este electrolito inerte no reaccionan con los otros iones de las disoluciones, y no son ni reducidos ni oxidados en los electrodos.
La reacción que ocurre en la pila de Daniell es la misma que ocurre cuando el 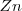 reacciona directamente con el
reacciona directamente con el 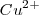 solo que ahora debido a que el metálico y los iones cobre están en compartimentos separados, los electrones son transferidos desde el
solo que ahora debido a que el metálico y los iones cobre están en compartimentos separados, los electrones son transferidos desde el 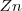 al
al 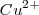 a través del hilo conductor. Por consiguiente la semireacciones de oxidación y reducción ocurren en electrodos separados y la corriente eléctrica fluye a través del hilo conductor. Los electrones no son transferidos a través de la solución debido a que el hilo conductor de metales mucho mejor conductor de los electrones que el agua. De hecho, los electrones libres reaccionan rápidamente con el agua y por lo tanto son inestables en soluciones acuosas.
a través del hilo conductor. Por consiguiente la semireacciones de oxidación y reducción ocurren en electrodos separados y la corriente eléctrica fluye a través del hilo conductor. Los electrones no son transferidos a través de la solución debido a que el hilo conductor de metales mucho mejor conductor de los electrones que el agua. De hecho, los electrones libres reaccionan rápidamente con el agua y por lo tanto son inestables en soluciones acuosas.
El electrodo en el cual la oxidación tiene lugar es llamado ánodo (en este ejemplo la barra metálica de cinc), mientras que el electrodo en el cual tiene la reacción de reducción es llamado cátodo (la barra de cobre). El ánodo y el cátodo deben su nombre a la dirección del flujo entre los dos compartimentos: Aniones se mueven hacia el ánodo y cationes hacia el cátodo.
El electrodo de cinc es, respecto de la disolución, el ánodo, es decir el electrodo positivo, y en él tiene lugar la semireacción de oxidación:
Semireacción anódica (Oxidacción): 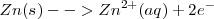
El electrodo de cobre actúa como cátodo, actuando como electrodo negativo que atrae a los cationes 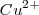 reduciéndolos.
reduciéndolos.
Semireacción catódica (Reducción): 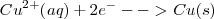
En consecuencia la barra de cinc se va deshaciendo en tanto que la de cobre acrece por depósito de cobre metálico. Y el proceso continúa mientras no falte cinc metálico o iones cobre (II).
La reacción global será, sumando las dos semireacciones:
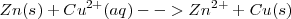
Existe una notación sencilla convencional para representar los distintos tipos de pila, en las que se refleja la naturaleza química de los electrodos y las disoluciones en contacto. Así para la pila de Daniell estudiada, el esquema propio de forma simplificada es: