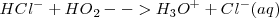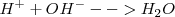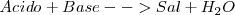Conceptos históricos de ácido y base. Teoría de Arrhenius
De Wikillerato
La palabra ácido procede del latín acidus que significa agrio, que indica la cualidad del sabor de ciertas frutas (e.g. limón) o sustancias como la vinagre. Por otro lado se conocía desde antiguo que al quemar plantas se puede obtener un residuo que es capaz de anular las propiedades de las sustancias ácidas, y al que se llamó álcali, palabra de origen árabe que significa “ceniza vegetal”; este término se ha usado tradicionalmente para designar lo que hoy entendemos en química como base.
El científico inglés Robert Boyle (1627-1691), en el siglo XVII, caracterizó a los ácidos como sustancias que atacan el mármol con efervescencia y enrojecen los pigmentos azules de algunas plantas. Durante el siglo siguiente Antoine Laurent Lavoisier (1743-1794) consiguió al disolver en agua óxidos no metálicos, producir ácidos como el sulfúrico, el carbónico y el nítrico. Proponiendo en 1777 que el oxígeno (palabra de origen griego oxígeno, que significa, “generador” o “formador de “agudo” o “ácido”) era el elemento común a todos los ácidos. Sin embargo, las investigaciones de Sir Hamphy Davy (1778-1829) un químico inglés de principios del siglo XIX, demostraron que había ácidos que no tenían oxígeno- los que hoy llamamos hidrácidos, como ácido clorídrico 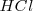 o cianídrico
o cianídrico 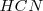 y que en definitiva el elemento común a todos los ácidos era el hidrógeno.
y que en definitiva el elemento común a todos los ácidos era el hidrógeno.
Propiedades empíricas de los ácidos y de las bases
Por la tradición operativa acumulada en los laboratorios, los químicos ya conocían varias propiedades químicas de las sustancias que se habían catalogado como ácidos:
1.- En contacto con carbonatos y bicarbonatos, producen efervescencia porque liberan gas carbónico.
2.- Atacan a los metales con liberación de gas hidrógeno.
3.- Dan rojo al tornasol, una mezcla de colorantes extraídos de líquenes.
4.- Tiene sabor agrio.
5.- Destruyen los tejidos de los seres vivos, sobre todo en disoluciones concentradas
También ciertas propiedades observadas experimentalmente permiten clasificar a otro grupo de sustancias, antagonistas de los ácidos llamadas bases o álcalis, que no producen efervescencia con los carbonatos ni desprenden hidrógeno con los metales, y cambian el color rojo del tornasol que ha sido expuesto a los ácidos por color azul. Las bases reaccionan con los ácidos anulando sus propiedades en un proceso conocido como neutralización.
Teoría de Arrhenius o de la disociación electrolítica
En 1887 el químico sueco Svante August Arrhenius (1859-1927) publicó su teoría sobre la naturaleza de los ácidos, aun cuando los conocimientos sobre la estructura de la materia se limitaban prácticamente a la existencia de átomos y moléculas. Se desconocían las partículas subatómicas, como el electrón y el protón. Sin embargo era conocido por los estudios de electrolisis de Michael Faraday (1791-1867) que ciertas sustancias disueltas en agua, como los ácidos, las bases y las sales, conducían corriente eléctrica. Las disoluciones así formadas, a las que se llamo electrólitos, presentaban también un comportamiento anómalo en las propiedades llamadas coligativas, como los puntos de ebullición y congelación y la presión de vapor, que dependen del número de partículas de soluto por unidad de volumen de la disolución: un mol de un electrólito producía más partículas en disolución que un mol de un no electrólito.
Arrhenius trató de explicar estos hechos mediante su Teoría de disociación electrolítica (que inicialmente fue rechazada, pero que resulto de enorme fecundidad para el desarrollo posterior de la Química). La teoría postulaba que las sustancias llamadas electrólitos (ácidos, bases y sales) en disolución (e.g. en agua) o fundidos, se disocian en iones, es decir en partículas cargadas eléctricamente, unas negativas llamadas aniones y otras positivas que reciben el nombre de cationes. El principio de conservación de la carga eléctrica determina que la carga total de los aniones iguales a la de los cationes, de tal manera que la disolución sea neutra, como eran el soluto y el disolvente por separado antes de la disolución.
Teniendo en cuenta este escenario conceptual, Arrhenius propone sus definiciones de ácido y de bases:
Ácido es toda sustancia que en disolución acuosa se disocia produciendo iones hidrógeno,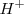
En general:
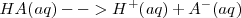
Ejemplo de ácido:
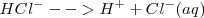
Aunque conveniente para ser usado en las ecuaciones, el símbolo 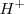 no representa la estructura del ión presente en la disolución acuosa. Un ión desnudo de hidrógeno (protón) con ningún electrón cercano
no representa la estructura del ión presente en la disolución acuosa. Un ión desnudo de hidrógeno (protón) con ningún electrón cercano 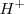 es muy rectivo como para existir pos si mismo. Más bien el
es muy rectivo como para existir pos si mismo. Más bien el 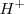 ataca a una molécula de agua
ataca a una molécula de agua 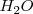 para dar un ión hidronio (oxonio) más estable
para dar un ión hidronio (oxonio) más estable 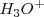 . Por ejemplo el cloruro de hidrógeno, por ejemplo origina iones
. Por ejemplo el cloruro de hidrógeno, por ejemplo origina iones 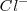 y
y 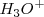 cuando es disuelto en agua.
cuando es disuelto en agua.
Ejemplo de ácido:
Base es toda sustancia que en disolución acuosa se disocia produciendo iones hidróxido,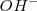
En general:
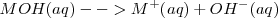
Ejemplo de base:
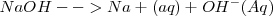
El símbolo 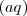 indica que el ión se encuentra hidratado, ose a, rodeado de moléculas de agua.
indica que el ión se encuentra hidratado, ose a, rodeado de moléculas de agua.
En la teoría de Arrhenius, la neutralización entre un ácido y una base se interpreta como la desaparición de los iones característicos, 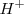 y
y 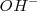 , que se combina entre sí para dar moléculas de agua:
, que se combina entre sí para dar moléculas de agua:
Que representa el clásico esquema de la neutralización:
Por supuesto quedan en disolución, sin alteración alguna, los iones 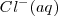 y
y 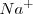 , que suelen llamarse iones espectadores, y son los que constituyen la sal.
, que suelen llamarse iones espectadores, y son los que constituyen la sal.
Algunas sustancias pueden actuar como ácidos y como bases, dependiendo del reactivo al que se enfrentan. Tales sustancias se denomina anfóteras o anfolitos, y un representante de las mismas es el hidróxido de aluminio 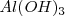 que actúa como un ácido frente a las bases y como una base frente a los ácidos.
que actúa como un ácido frente a las bases y como una base frente a los ácidos.
La teoría de Arrehnius a pesar de presentar una valiosa aportación al conocimiento de las reacciones químicas, encontró importantes objeciones experimentales que cuestionaban su validez. Compuestos tales como el amoniaco 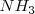 , o el carbonato de sodio,
, o el carbonato de sodio, 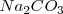 , presentaban un indiscutible comportamiento de bases, pero no encajaban en la teoría de Arrhenius porque no pueden contener grupos
, presentaban un indiscutible comportamiento de bases, pero no encajaban en la teoría de Arrhenius porque no pueden contener grupos 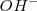 según su fórmulas químicas.
según su fórmulas químicas.
Fue necesario que avanzara el conocimiento de la compasión del átomo y de la naturaleza del enlace químico antes de que el terreno estuviera dispuesto para nuevas teorías que superasen las insuficiencias presentadas por la teoría de Arrhenius.