Enlace covalente
De Wikillerato
Enlace covalente
|
O dicho de otro modo:
|
Por ejemplo, en la molécula de hidrógeno 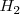 cuando los dos átomos de hidrógeno se acercan las interacciones electrostáticas comienzan a desarrollarse entre ellos. Las dos cargas positivas de los núcleos se repelen la una a la otra al igual que los dos electrones cargados, pero cada núcleo atrae a ambos electrones. Si la fuerza atractiva es más fuerte que la fuerza repulsiva, el enlace covalente es formado, con los dos átomos unidos juntos y los dos electrones compartidos ocupando la región entre los núcleos.
cuando los dos átomos de hidrógeno se acercan las interacciones electrostáticas comienzan a desarrollarse entre ellos. Las dos cargas positivas de los núcleos se repelen la una a la otra al igual que los dos electrones cargados, pero cada núcleo atrae a ambos electrones. Si la fuerza atractiva es más fuerte que la fuerza repulsiva, el enlace covalente es formado, con los dos átomos unidos juntos y los dos electrones compartidos ocupando la región entre los núcleos.
En esencia los electrones compartidos actúan como una especie de “pegamento” que unen los dos núcleos juntos en una molécula de hidrógeno. Ambos núcleos atraen simultáneamente a los mismos electrones y por ello se mantienen unidos, usando una analogía, sería parecido al "juego de tira y afloja" con dos equipos que tirando de la misma cuerda se mantienen unidos.
La magnitud de las varias fuerzas atractivas y repulsivas entre los núcleos y los electrones en un enlace covalente depende de lo próximos que los átomos estén. Si los átomos de hidrógenos están muy alejados las fuerzas atractivas son pequeñas y el enlace no existe. Por el contrario, si los átomos de hidrógeno están muy próximos las fuerzas de repulsión entre los átomos son demasiado fuertes y provocan la separación de los átomos. Así, hay una distancia óptima entre los núcleos de hidrógeno llamada la longitud de enlace donde las fuerzas netas de atracción son maximizadas y la molécula 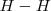 es más estable. En la molécula de hidrógeno
es más estable. En la molécula de hidrógeno 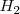 , la longitud de enlace es de 74 pm (picometros). Si se representa en una gráficala distancia versus la distancia internuclear, la longitud de enlace corresponde al mínimo de energía, el ordenamiento más estable.
, la longitud de enlace es de 74 pm (picometros). Si se representa en una gráficala distancia versus la distancia internuclear, la longitud de enlace corresponde al mínimo de energía, el ordenamiento más estable.
Cada enlace covalente tiene su propia longitud de enlace característica que conduce a la máxima estabilidad y que es aproximadamente predecible a partir del conocimiento del radio atómico de los átomos que paricipan en el enlace covalente. Por ejemplo debido a que el radio del hidrógeno es de 37 pm y el radio atómico del cloro es 99 pm, la longitud de enlace  en la molécula de cloruro de hidrógeno es aproximadamente de 37pm+99pm=136 pm (el valor real es de 127 pm).
en la molécula de cloruro de hidrógeno es aproximadamente de 37pm+99pm=136 pm (el valor real es de 127 pm).



