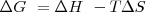Espontaneidad en las reacciones químicas: Energía libre de Gibbs
De Wikillerato
Energía Libre de Gibbs
La energía libre de Gibbs una función de estado introducida por el científico norteamericano Josiah Willard Gibbs (1839-1903) uno de los fundadores de la termodinámica química o termoquímica y es definida como:
La introducción de esta función permite evitar el problema que resulta del calculo de la entropía total (Universo, 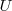 ) del sistema más entorno (
) del sistema más entorno ( ) en proceso
) en proceso 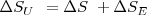 , la cual nos dice la tendencia a la espontaneidad de un proceso (según la segunda ley de la termodinámica, si
, la cual nos dice la tendencia a la espontaneidad de un proceso (según la segunda ley de la termodinámica, si 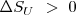 el proceso puede ocurrir espontáneamente) , pues mientras el calculo del cambio de entropía del sistema
el proceso puede ocurrir espontáneamente) , pues mientras el calculo del cambio de entropía del sistema 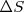 puede ser encontrada con facilidad (aunque de modo indirecto) no así el de los alrededores o entorno, parece claro que es difícil de medir los cambios de entropía del resto del Universo fuera del sistema. Por ello sería conveniente la introducción de una función que dependiera solo de la entropía del sistema
puede ser encontrada con facilidad (aunque de modo indirecto) no así el de los alrededores o entorno, parece claro que es difícil de medir los cambios de entropía del resto del Universo fuera del sistema. Por ello sería conveniente la introducción de una función que dependiera solo de la entropía del sistema 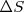 y que nos diera además información (un criterio) sobre la espontaneidad de un proceso físico o químico (e,g, una reacción química) . Esta función la cumple la energía libre de Gibbs.
y que nos diera además información (un criterio) sobre la espontaneidad de un proceso físico o químico (e,g, una reacción química) . Esta función la cumple la energía libre de Gibbs.
Como en el caso de la entalpíay de la energía interna solo podemos merdir el cambio en la energía libre de Gibbs. Para un proceso que ocurre a temperatura y presión constante:
Donde:
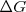 : El cambio en la energía libre de Gibbs
: El cambio en la energía libre de Gibbs
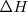 : El cambio en la entalpía
: El cambio en la entalpía
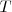 : temperatura absoluta (en kelvin)
: temperatura absoluta (en kelvin)
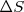 : El cambio en la entropía del sistema
: El cambio en la entropía del sistema
Como la energía libre de Gibbs depende de otras funciones de estado termodinámicas: la entalpía y la entropía, se mide en las mismas unidades que la entalpía: 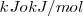 .
.
Que es lo que distingue 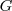 de la energía interna
de la energía interna 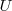 y entalpía
y entalpía 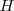 ?
?
La energía libre es un energía es energía que es disponible en una forma que puede ser usada para realizar trabajo.
Esto es, la energía libre de Gibbs mide la cantidad máxima de trabajo que puede ser hecho por un proceso desde una situación de no equilibrio a una de equilibrio (a temperatura constante y presión constante).
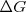 y la espontaneidad de las reacciones químicas
y la espontaneidad de las reacciones químicas
El valor del cambio de la energía libre de Gibbs 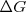 es un criterio general para la espontaneidad de un proceso químico o físico.
es un criterio general para la espontaneidad de un proceso químico o físico.
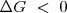 ; Proceso espontáneo, la reacción tiene lugar en el sentido directo
; Proceso espontáneo, la reacción tiene lugar en el sentido directo
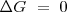 ; El proceso está en equilibrio, ni espontáneo ni no espontáneo, no hay cambio
; El proceso está en equilibrio, ni espontáneo ni no espontáneo, no hay cambio
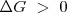 ; Proceso no espontáneo, tiende a producirse en sentido inverso en la forma espontánea.
; Proceso no espontáneo, tiende a producirse en sentido inverso en la forma espontánea.
La diferencia de signo entre 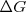 y
y 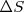 implica que las condiciones para la espontaneidad de un proceso cambian en términos de entropía total
implica que las condiciones para la espontaneidad de un proceso cambian en términos de entropía total 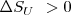 (lo cual es universalmente cierto por la segunda ley de la termodinámica) a
(lo cual es universalmente cierto por la segunda ley de la termodinámica) a 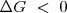 en termino de la energía libre de Gibbs (para procesos que ocurren a presión y temperatura constante).
en termino de la energía libre de Gibbs (para procesos que ocurren a presión y temperatura constante).
El hecho de que 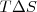 en la ecuación
en la ecuación ![[2] [2]](/images/math/math-6c6ff933a74728e9f85b8bf5ee5d99e8.png) es dependiente de la temperatura implica algunos procesos pueden ser espontáneos o no espontáneos dependiendo de la temperatura. Por ejemplo a baja temperatura un término desfavorable (positivo)
es dependiente de la temperatura implica algunos procesos pueden ser espontáneos o no espontáneos dependiendo de la temperatura. Por ejemplo a baja temperatura un término desfavorable (positivo) 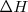 puede ser más grande que un termino favorable (positivo)
puede ser más grande que un termino favorable (positivo) 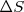 , pero a una temperatura mayor el termino
, pero a una temperatura mayor el termino 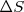 puede ser mucho mayor. Así un proceso endotérmico que no es espontáneo a una baja temperatura puede serlo a una temperatura mayor.
puede ser mucho mayor. Así un proceso endotérmico que no es espontáneo a una baja temperatura puede serlo a una temperatura mayor.
Por ello, para saber si un proceso es espontáneo se deben tener en cuanta dos factores: el valor absoluto y el signo de 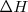 y
y 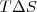 . Una reacción exotérmica (
. Una reacción exotérmica ( ) puede no ser espontánea, y por el contrario, una reacción endotérmica
) puede no ser espontánea, y por el contrario, una reacción endotérmica 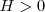 ) puede serlo si aumenta mucho la entropía.
) puede serlo si aumenta mucho la entropía.


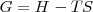
![[1] [1]](/images/math/math-a5e3f5e17b927757c8bfa5f817bc504e.png)