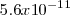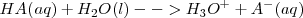Fuerza de los ácidos
De Wikillerato
Tabla de contenidos[ocultar] |
Fuerza o debilidad de ácidos y bases
Diferentes ácidos con la misma molaridad producen en disolución acuosa distintas concentraciones de iones hidronios 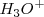 , y lo mismo puede decirse de las bases con respecto al ión hidróxido
, y lo mismo puede decirse de las bases con respecto al ión hidróxido 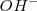 . Es to es el grado de disociación (ionización) alcanza más o menos grado de extensión entre las distintos ácidos y bases.
. Es to es el grado de disociación (ionización) alcanza más o menos grado de extensión entre las distintos ácidos y bases.
Ácidos y bases fuertes
Los ácidos fuertes son aquellos que se encuentran totalmente ionizados (100%) en disolución acuosa:
En esto la concentración de iones hidronios 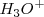 y la concentración de
y la concentración de 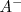 son iguales a la concentración inicial del ácido
son iguales a la concentración inicial del ácido 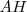 .
.
Ejemplos de ácidos fuertes son los ácidos monopróticos (solo tienen un hidrógeno ionizable)
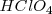 ; el ácido clorhídrico (
; el ácido clorhídrico (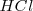 ) y
) y 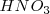
Por ejemplo un mol de ácido clorhídrico produce un mol de iones hidronio y una base fuerte es el hidróxido de potasio (sosa cáustica) 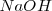 y hidróxido de potasio (potasa cáustica)
y hidróxido de potasio (potasa cáustica) 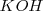 . Estos compuestos de formula general
. Estos compuestos de formula general  son sólidos iónicos solubles en agua que existen en soluciones acuosas como cationes metálicos alcalinos (
son sólidos iónicos solubles en agua que existen en soluciones acuosas como cationes metálicos alcalinos (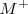 ) y aniones
) y aniones 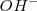 :
:
100%
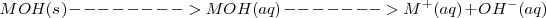
Una disolución de 0.10 M de 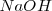 contiene 0.10 M de iónes hidróxido
contiene 0.10 M de iónes hidróxido 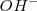
Ácidos y bases débiles
Un ácido o una base débil no es la misma cosa que una solución de un ácido fuerte. Así, mientras que un ácido fuerte esta disociado (ionizado) al 100 % en solución acuosa, un ácido débil está disociado parcialmente. Al disolverse en agua se establece un equilibrio químico más o menos desplazado hacia la izquierda.
En términos generales:
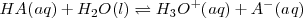
Ejemplos:
Disociación de un ácido débil:

Disociación de una base débil:
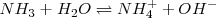
Un mol de ácido cianhídrico 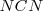 no produce un mol de iones hidronios, ni un mol de amoniaco (
no produce un mol de iones hidronios, ni un mol de amoniaco (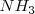 produce un mol de iones hidróxido, sino menos de un mol, cantidad que dependerá de los valores que tengan las correspondientes constantes de equilibrio.
produce un mol de iones hidróxido, sino menos de un mol, cantidad que dependerá de los valores que tengan las correspondientes constantes de equilibrio.
Entre los ácido débiles inorgánicos podemos citar los ácidos: cianídrico, carbónico, sulfidrico y fluorhídrico. En esta clase de ácidos se incluyen también los ácidos orgánicos carboxílicos, como por ejemplo el ácido acético. Los ácidos carboxílicos ionizan el hidrógeno del grupo carboxilo:
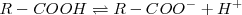
La base débil más importante es el amoniaco.
Ácidos polipróticos
Son aquellos que poseen más de un hidrógeno ionizable. Los ácidos polipróticos se disocian en sucesivas etapas y cada etapa y cada disociación es caracterizada por su constante de disociación ácida. Por el ejemplo el ácido sulfúrico 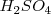 es un ácido diprótico, que se comporta como fuerte en la primera disociación y débil en las segunda:
es un ácido diprótico, que se comporta como fuerte en la primera disociación y débil en las segunda:

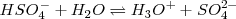
Debido a las fuerzas electrostáticas es más difícil liberar un protón cargado positivamente a partir de los iones como el 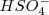 que retine con más fuerza al protón que a partir de
que retine con más fuerza al protón que a partir de 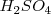 , por ello los valores de las constantes de disociación de cada etapa de los ácidos polipróticos disminuyen típicamente por un valor de
, por ello los valores de las constantes de disociación de cada etapa de los ácidos polipróticos disminuyen típicamente por un valor de 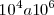
Por ejemplo el ácido carbónico es un ácido diprótico sufre las siguientes reacciones de disociación:
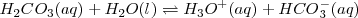
Equilibrio que tiene una constante ácida de disociación 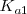 de
de 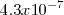
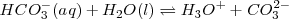
Equilibrio que tiene una constante de disociación de 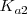 de
de