Indicadores de pH
De Wikillerato
Indicadores de pH
El pH aproximado de una solución puede ser determinado usando un indicador ácido-base o indicador de pH. Un indicador (abreviadamente 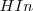 ) es un cierto tipo de sustancia colorante que cambia de color en un determinado rango de pH. Los indicadores muestran un cambio de color, llamado viraje, debido a que el indicador es bien un ácido débil o una base débil, y en disolución existe en un equilibrio entre el ácido y su base conjugada, o bien entre la base y su ácido conjugado, y las dos especies químicas que forman el par conjugado tienen distinto color.
) es un cierto tipo de sustancia colorante que cambia de color en un determinado rango de pH. Los indicadores muestran un cambio de color, llamado viraje, debido a que el indicador es bien un ácido débil o una base débil, y en disolución existe en un equilibrio entre el ácido y su base conjugada, o bien entre la base y su ácido conjugado, y las dos especies químicas que forman el par conjugado tienen distinto color.
Supongamos que el indicador es un ácido débil que se disocia según la ecuación del equilibrio:
Color A Color B
Si el medio es ácido (debido a las altas concentraciones de iones hidronios), el equilibrio estará desplazado hacia la izquierda, predominado por ello la forma ácida de indicador (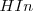 que dará su color A a la disolución. Para bajas concentraciones de iones hidronios (soluciones básicas), el equilibrio se desplazará hacia la derecha, y el color de la disolución será el B característico de la base conjugada (
que dará su color A a la disolución. Para bajas concentraciones de iones hidronios (soluciones básicas), el equilibrio se desplazará hacia la derecha, y el color de la disolución será el B característico de la base conjugada (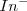 ).
).
La fenolftaleína es uno de los indicadores más empleados, es incolora en medio ácido y roja en medio básico (alcalino), más precisamente es incolora por debajo de un 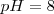 y roja por encima de
y roja por encima de 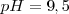 . Otro ejemplo de indicador es el azul de bromotimol que cambia de color en el rango de
. Otro ejemplo de indicador es el azul de bromotimol que cambia de color en el rango de 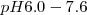 desde la froma incolora de la forma ácida a rosa en su forma de base.
desde la froma incolora de la forma ácida a rosa en su forma de base.
Debido a que los indicadores cambian de color en un rango de aproximadamente 2 unidades de pH, es posible determinar el valor de pH de una solución dentro de aproximadamente una unidad de pH por encima o por debajo, añadiendo unas gotas del indicador que cambia de color en el apropiado rango de pH.
Para hacer la determinación del pH más fácil una mezcla de indicadores conocido como indicador universal, que es una mezcla de indicadores que produce virajes en intervalos sucesivos de dos unidades de pH, permitiendo llevar a cabo medidas aproximadas de pH en un intervalo de 2-10. Una mezcla clásica es la de rojo de metilo, dimetil amino benceno, azul de bromotimol y azul de timol, que ofrece la siguiente secuencia de coloraciones: rojo a pH 2; anaranjado a pH 4; amarillo a pH 6; verde a pH 8, y azul a pH 10. Con ello se obtiene una determinación aproximada al pH de la disolución.
El papel indicador universal disponible comercialmente es una tira de papel absorbente impregnado por una mezcla de colores que pueden adoptar diferentes tonalidades de una gama de colores, según el pH de la disolución que se está estudiando.
A nivel molecular, el cambio de color de los indicadores se debe a una alteración del sistema cromóforo de sus moléculas por vinculación o eliminación de un protón. Por ejemplo la fenolftaleína, que es incolora en medio ácido, pero que al perder protones en medio básico, forma un extenso sistema resonante capaz de provocar la absorción de radiación dentro del espectro visible y con ello la parición del color rojo.
pH-metros
Para la medida del pH de una disolución se utilizan instrumentos llamados pH-metros cuyo funcionamiento se basa en la electroquímica y que mide la dependencia con el pH del potencial eléctrico de la solución test.



