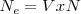Valoración de una disolución acuosa. Volumetrías ácido-base
De Wikillerato
Reacciones de Neutralización
Neutralización ácido-base
Neutralización es el proceso químico fundamental por el que un ácido reacciona con una base para producir agua y sal. La sal es un compuesto iónico formado por un anión (con carga negativa) y un catión (que porta carga positiva).
En la teoría de Arrhenius, la neutralización entre un ácido y una base se interpreta como la desaparición de iones característicos, 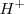 y
y 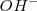 , que se combinan entre si para dar moléculas de agua
, que se combinan entre si para dar moléculas de agua
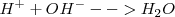
El esquema clásico de neutralización es:
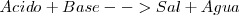
Para que la disolución resultante alcance la neutralidad es necesario que el número de iones hidronios iguale al de iones hidróxido, esto es que el número de moles de unos y otros sea igual.
Para manejar de manera cómoda y sencilla cantidades exactas de ácidos y bases, en las reacciones de neutralización, los químicos introdujeron el concepto de equivalente ácido-base.
Equivalente ácido-base
Equivalente de un ácido es la cantidad del mismo que libera un mol de protones.
Equivalente de una base es la cantidad de la misma que capta un mol de protones o que también libera un mol de iones hidróxido.
En los ácidos monopróticos, su mol coincide con su equivalente. Cuando el ácido es poliprótico, su equivalente es igual a su mol dividido por el número de hidrógenos ionizables que posee su molécula. De igual manera ocurre para las bases, solo que el número de hidrógenos ionizables se cambia por el número de iones hidróxido.
Cuando se mezclan una disolución de un ácido y una base se dice que se ha alcanzado el punto de equivalencia cuando el número de equivalente de ácidos añadidos iguala al de equivalentes de la base.
Si el ácido y la base son fuertes, el punto de equivalencia coincide con el punto de neutralidad, esto es, con el estado de 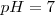 . Si por el contrario, lel ácido o la base es débil, ambos puntos no coincidirán porque la sal formada en la neutralización experimentará hidrólisis y el
. Si por el contrario, lel ácido o la base es débil, ambos puntos no coincidirán porque la sal formada en la neutralización experimentará hidrólisis y el 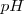 resultante no será 7.
resultante no será 7.
La concentración de las disoluciones de ácidos y bases pueden expresarse en términos de equivalentes mediante la Normalidad (N):
Normalidad de una disolución es el número de equivalentes de soluto contenidos en un litro de la misma
La siguiente ecuación relaciona la Normalidad (N) con la Molaridad (M):
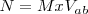
Siendo la valencia ácido-base (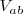 para un ácido el número de hidrógenos ionizables del mismo; y en el caso de una base, el número de iones hidróxidos que puede liberar.
para un ácido el número de hidrógenos ionizables del mismo; y en el caso de una base, el número de iones hidróxidos que puede liberar.
El número de equivalentes (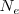 contenidos en una disolución cuyo volumen de litros sea V nos lo da la relación:
contenidos en una disolución cuyo volumen de litros sea V nos lo da la relación: