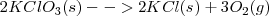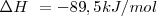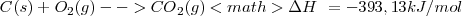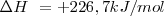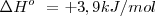Ecuaciones termoquímicas
De Wikillerato
(Página nueva: Ecuaciones termoquímicas Las ecuaciones termoquímicas son aquellas en la que se representan los cambios materiales y energéticos que ocurren en las reacciones químicas. En ellas ...) |
|||
| (Una edición intermedia no se muestra.) | |||
| Línea 1: | Línea 1: | ||
| - | |||
| - | |||
Las ecuaciones termoquímicas son aquellas en la que se representan los cambios materiales y energéticos que ocurren en las reacciones químicas. En ellas se muestra el estado de agregación de cada sustancia que interviene en la reacción y el balance energético del proceso indicado generalmente como la variación de entalpía. | Las ecuaciones termoquímicas son aquellas en la que se representan los cambios materiales y energéticos que ocurren en las reacciones químicas. En ellas se muestra el estado de agregación de cada sustancia que interviene en la reacción y el balance energético del proceso indicado generalmente como la variación de entalpía. | ||
| Línea 25: | Línea 23: | ||
Reacción exotérmica (<math>\Delta H\ < 0 </math> ) | Reacción exotérmica (<math>\Delta H\ < 0 </math> ) | ||
| - | <math> C (S) + H_2 (g) --> C_2H_2 (g) </math> <math>\Delta H \ = 226, 7 kJ/mol </math> | + | <math> C (S) + H_2 (g) --> C_2H_2 (g) </math> <math>\Delta H \ = + 226, 7 kJ/mol </math> |
Reacción endotérmica (<math>\Delta H \ > 0 </math>) | Reacción endotérmica (<math>\Delta H \ > 0 </math>) | ||
Revisión actual
Las ecuaciones termoquímicas son aquellas en la que se representan los cambios materiales y energéticos que ocurren en las reacciones químicas. En ellas se muestra el estado de agregación de cada sustancia que interviene en la reacción y el balance energético del proceso indicado generalmente como la variación de entalpía.
Por ejemplo:
Una forma de obtener oxígeno en el laboratorio es descomponer térmicamente el clorato de potasio 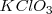 según la reacción:
según la reacción:
Donde (s), para sólido, g (gases) indican abreviadamente el estado material de los reactivos y de los productos.
Los cálculos de las ecuaciones químicas se aplican de esta manera no solo a las cantidades de moléculas y los moles de las sustancias que intervienen sino también a los calores o entalpías de reacción, teniendo en cuenta que estos vienen dados en kJ por mol (Kilojulios por mol). En la ecuación anterior, la variación de entalpía de la reacción en kJ/mol esta escrita a la derecha y se refiere a la ecuación tal cual está escrita. Este calor se desprende por mol de ecuación, o por cada dos moles de clorato potásico o por cada tres moles de oxigeno que se obtiene.
Cuando una reacción química ocurre puede liberar energía en modo de calor al entorno o puede absorber calor del mismo. De acuerdo con el criterio de signos utilizados, si sistema cede energía al entorno se dice entonces que la reacción es una reacción exotérmica) y 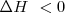 y por el contrario si el sistema de reacción toma energía calorícia del exterior la reacción es una reacción endotérmica y entonces
y por el contrario si el sistema de reacción toma energía calorícia del exterior la reacción es una reacción endotérmica y entonces 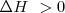 .
.
Ejemplos:
Reacción exotérmica (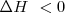 )
)
)
Reacción exotérmica (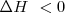 )
)
Reacción endotérmica (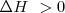 )
)
Cuando la sal común NaCl se disuelve en agua, una pequeña cantidad de energía calorífica es absorbida
Reacción endotérmica (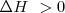 )
)
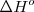 indica que la reacción se realiza en condiciones estándar 25 ºC (298 K) y 1 atm de presión.
indica que la reacción se realiza en condiciones estándar 25 ºC (298 K) y 1 atm de presión.