Geometría de las moléculas. Teoría de la repulsión de pares electrónicos de Gilespie
De Wikillerato
Geometría Molecular
La disposición en el espacio de los átomos que componen una molécula constituye la geometría molecular de la misma. Aunque para ser más exactos se debería decir la disposición de lo núcleos atómicos, porque ésta se puede conocer mediante las técnicas experimentales mientras que de las cortezas electrónicas son por naturaleza mucho más difusa en su disposición.
El conocimiento de la geometría molecular es fundamental para deducir propiedades de una molécula determinada; por ejemplo, la polaridad, de la cual dependen propiedades químicas fundamentales como la solubilidad y la reactividad.
Varios métodos han sido desarrollados para la deducción de la geometría molecular, uno de los métodos más corrientes es la llamada Teoría de repulsión de pares electrónicos de la capa de valencia (RPECV).
Método de la RPECV
Este método es una extensión lógica de la teoría de Lewis del enlace covalente, está basado en un fundamento sencillo y fue propuesto por Sidgwick y Powell en 1940, y perfeccionado por Guillespie y Nyholm en 1957.
El método RPECV se limita a considerar las interacciones electrónicas, sean enlazantes o antienlazantes, presentes en la capa de valencia de un átomo dentro de la molécula prescindiendo de consideraciones mecanocuánticas.
Se denominan bloques electrónicos a los conjuntos de electrones que se mueven de manera solidaria bajo el efecto de las repulsiones eléctricas en el entorno del átomo central de la molécula. Un bloque electrónico puede estar constituido por uno de los siguientes sistemas: pareja enlazante, pareja no enlazante, enlace doble y enlace triple.
El estudio se realiza en torno a un átomo central que enlazará dos o másátomos periféricos o ligandos. Primeramente se simplificará la cuestión limitándose a los casos en los que el átomo central soporte dos, tres o cuatro bloques electrónicos. Los bloques electrónicos se sitúan a una distancia constante del átomo central, disponiéndose en una superficie esférica equipotencial lo más separados posibles, de modo que la repulsión mutua le lleve a una situación de mínima energía.
En el caso de dos bloques de repulsión estos ocuparan los extremos de un diámetro, tres bloques se dispondrán en los vértices de un triángulo equilátero inscrito en un círculo máximo y cuatro bloques se situarán en los vértices de un tetraedro regular.
Teniendo en cuenta esto, la geometría molecular dependerá del número de átomos periféricos presentes en cada caso, así tenemos que la geometría molecular con:
a) Dos bloques electrónicos
En este caso sólo se pueden considerar moléculas triatómicas, pues no tiene sentido cuestionar la geometría de una molécula diatómica. Debido a que los bloques electrónicos se colocan en los extremos de un diámetro, y como detrás de cada bloque electrónico hay un átomo periférico, la molécula tendrá geometría lineal. Ejemplo de esta geometría es el dióxido de carbono 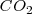 , donde cada enlace doble constituye un bloque electrónico.
, donde cada enlace doble constituye un bloque electrónico.
b) Tres bloque electrónicos
En este caso tenemos dos posibilidades:
1. Moléculas triatómicas. Dos bloques tienen que ser enlazantes y el tercero no enlazante. Los átomos periféricos ocupan los vértices de un triángulo equilátero y forman con el átomo central una estructura angular. Ejemplo de esta geometría la tenemos en el dióxido de azufre (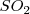 ), que tiene una pareja no enlazante y dos dobles enlaces.
), que tiene una pareja no enlazante y dos dobles enlaces.
2. Moléculas tetraatómicas: los tres bloques electrónicos son enlazantes, por lo que los cuatro átomos se disponen en un plano, ocupando, respectivamente, el centro y los vértices de un triángulo equilátero. La geometría en este caso es plana. Un ejemplo de la misma la tenemos en el trifluoruro de boro
c) Cuatro bloques electrónicos
En este caso se pueden distinguir tres posibilidades:
1. Moléculas pentaatómicas: los cuatro bloques son enlazantes y los lingandos se disponen en los vértices de un tetraedo regular. La geometría es pues tetraédrica. La molécula de metano 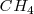 es un ejemplo característico de esta geometría.
es un ejemplo característico de esta geometría.
2. Moléculas tetraatómicas: uno de los vértices es ocupado por una pareja no enlazante y los otros tres por ligandos. El resultado es una molécula con geometría piramidal triangular. Un ejemplo típico de esta geometría es la que posee la molécula de amoniaco (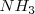 ).
).
3.Moléculas triatómicas: dos vértices están ocupados por parejas enlazantes y otros dos por ligandos, dando como resultado una molécula que es angular. El ejemplo más notable de esta geometría es la de la molécula de agua (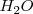 ).
).
d) Cinco o más bloques electrónicos
Existen moléculas con cinco o más bloques electrónicos, aunque son menos abundantes y su geometría es algo más complicada. La disposición de cinco cargas eléctricas en torno a un núcleo no tiene una única solución sino dos, con energía diferenciadas. Un ejemplo interesante de moléculas con seis pares de electrones enlazantes, las cuales disponen sus átomos periféricos en los vértices de un octaedro regular, tal como ocurre en la molécula de hexafluoruro de azufre, (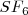 ).
).



